Luis Serrano-Andrés
M. Merchán
Juan José Serrano-Pérez
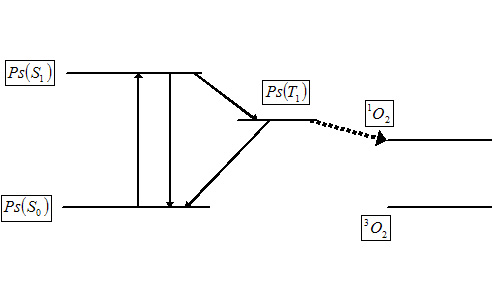
Dentro de la terapia PUVA distinguimos dos mecanismos de fotosensibilización posibles, que de acuerdo con diversos autores se clasifican como de Tipo II y de Tipo III. El mecanismo de Tipo II (conocido también como terapia fotodinámica, PDT) es dependiente del oxígeno y se basa en la transferencia de energía desde el primer estado excitado triplete del psoraleno al oxígeno molecular presente en el medio celular que a su vez se excita a oxígeno singlete reactivo. El oxígeno singlete, de naturaleza electrófila, reacciona con diversos componentes de la membrana celular provocando la muerte de la célula por apoptosis. Estos daños contribuyen a la fotosensibilización cutánea, mutación, reparación del DNA y carcinogénesis.
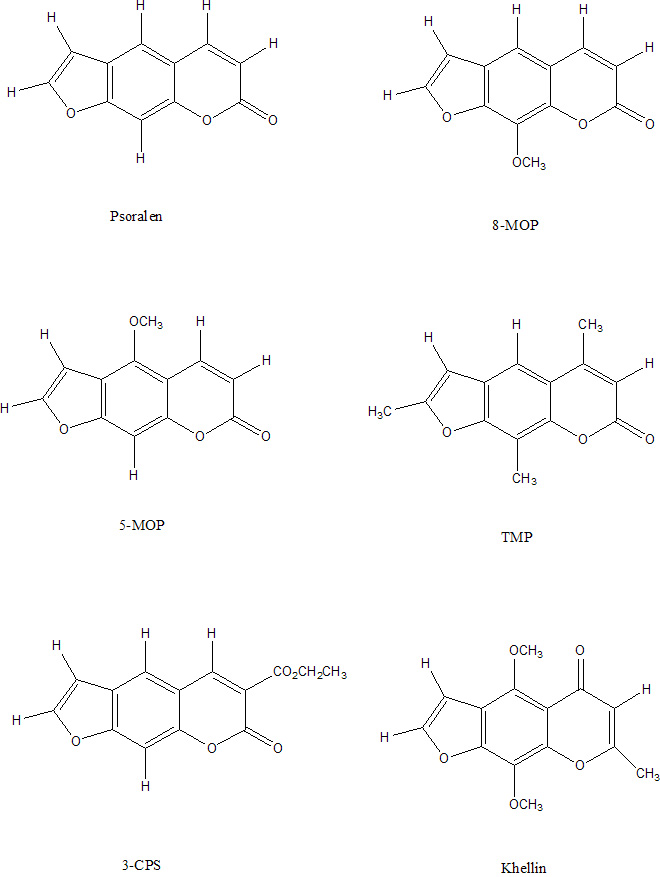
Por otra parte, el mecanismo de Tipo III es independiente del oxígeno, y se basa en la interacción entre el psoraleno y el DNA. Se trata de una fotocicloadición [2+2] en tres pasos: (i) la furocumarina se inserta entre bases pirimídinicas adyacentes en el DNA, (ii) la absorción de un fotón induce la formación de monoaductos entre un doble enlace reactivo (C5=C6) de la base pirimidínica (la más favorable es la timina) y los dobles enlaces reactivos de la furocumarina, pudiéndose formar dos tipos de monoaductos al existir dos dobles enlaces reactivos, uno en la parte de furano (C4´= C5´) y otro en la parte de pirano (C3=C4), y (iii) el monoaducto (sólo el formado por el lado del furano), merced a la absorción de un fotón, puede inducir a su otro doble enlace reactivo a interaccionar con una timina de la cadena opuesta de DNA, provocando la formación de un diaducto que entrecruza las dos hebras. Las regiones con secuencias poli[dA-dT]•poli[dA-dT] parecen ser las zonas más favorables para estas reacciones de fotocicloadición.
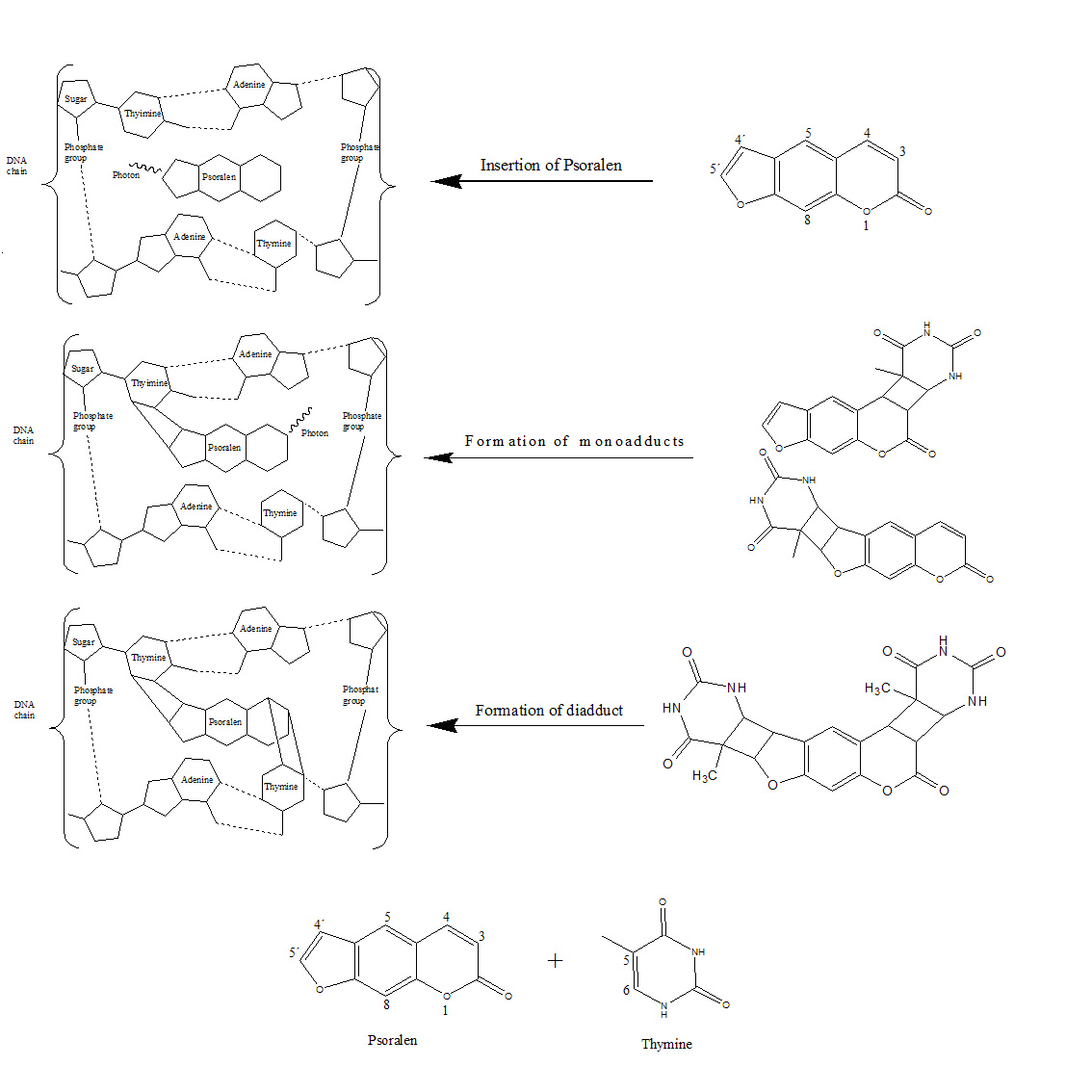
La efectividad fototerapéutica de las furocumarinas fue atribuida en primera instancia a la formación de entrecruzamientos entre las hebras del DNA, que tienen el inconveniente de no poder ser reparados con facilidad por los mecanismos de reparación del material genético, resultando ser mutagénicos y carcinogénicos. Pero estudios posteriores revelaron que ciertas furocumarinas monofuncionales (con sólo un doble enlace reactivo) presentaban una efectividad fotosensibilizadora del mismo orden que las furocumarinas bifuncionales, con lo que se puede colegir que no es únicamente la inducción de lesiones en el DNA el efecto responsable de la actividad fototerapéutica. Las furocumarinas presentan, amén de los mecanismos de fotosensibilización II y III, el llamado de Tipo I, que consiste en la formación de especies radicalarias tóxicas del oxígeno (O2•-; HO2•-), por interacción entre la furocumarina en estado triplete (al igual que en los otros dos mecanismos) y el oxígeno molecular.
La efectividad de la terapia PUVA se basa esencialmente en tres puntos: (i) inhibición de la síntesis de DNA, (ii) muerte de las células con proliferación anómala y (iii) inhibición de leucocitos. No obstante, el mecanismo fototerapéutico sólo se conoce a grandes rasgos. De hecho, se desconoce la razón por la cual la terapia PUVA es un tratamiento efectivo frente a un rango muy diverso de enfermedades. Cabe destacar, por ejemplo, el tratamiento de la degeneración macular y el cáncer, que se supone por un mecanismo Tipo II: en el primer caso se trata de sellar vasos sanguíneos que segregan fluidos y sangre impidiendo la visión, mientras que en el segundo caso se trata de destruir las células con una velocidad de división anormalmente alta. Se desconoce igualmente por qué el fármaco se concentra en las zonas dónde hay células en rápida división y no en otras zonas sanas, aunque se ha sugerido que este hecho es debido a que en la membrana de las células tumorales hay un elevado número de lipoproteínas de baja densidad (LDLs). Igualmente, observamos que se pueden tratar mediante PUVA enfermedades opuestas como psoriasis (debida a proliferación anormal de células) y vitíligo (debida a ausencia de melanocitos), ambas mediante el mecanismo de Tipo III, y en este caso el problema es aún mayor ya que ambas enfermedades son de origen idiopático.
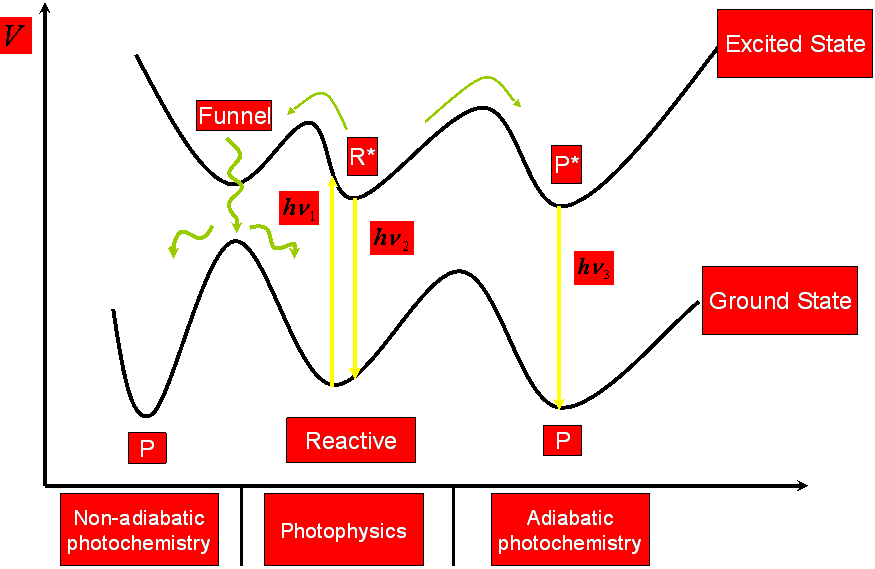
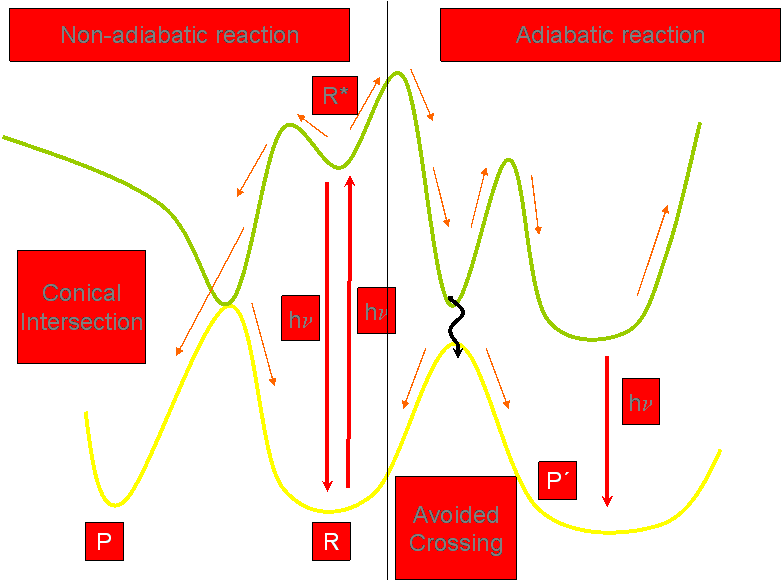
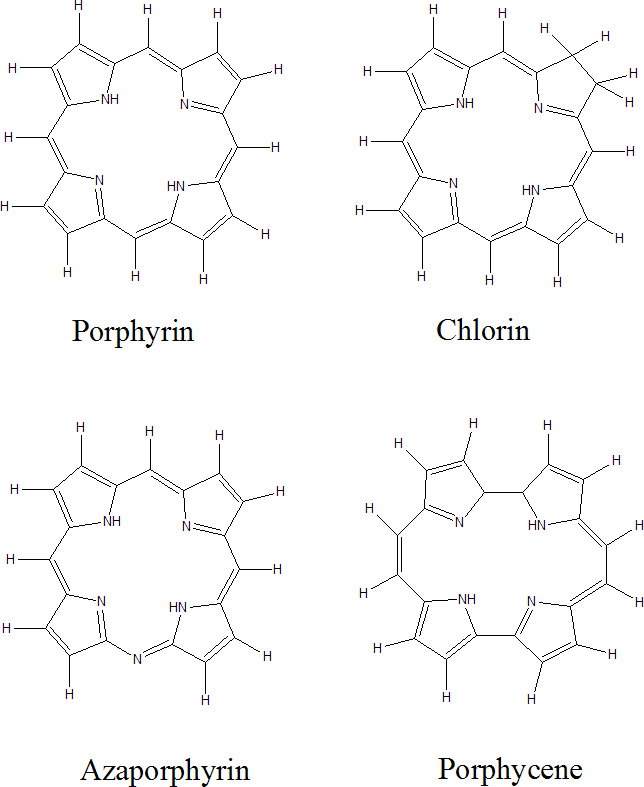
La comprensión de las propiedades fotofísicas de las furocumarinas en general y del psoraleno en particular es un paso crucial para racionalizar el mecanismo fototerapéutico. El estudio fotofísico del psoraleno y de miembros de la familia de las furocumarinas desde el punto de vista experimental ha sido desarrollado por varios grupos de investigación, obteniendo los espectros de absorción y de emisión, así como las principales propiedades espectroscópicas. Centrándonos en el psoraleno, las dos principales bandas de absorción están presentes en la región de baja energía del espectro: una débil y estructurada banda en la región de 360-270 nm (3.44-4.77 eV) y una banda puntiaguda a 240 nm (5.16 eV) en agua y en etanol. Las emisiones de fluorescencia y fosforescencia han sido detectadas a 409 nm (3.03 eV) y 456 nm (2.72 eV, 0-0), respectivamente, en etanol a 77 K. La razón entre los rendimientos cuánticos de fosforescencia/fluorescencia, 7.1, indica que el mecanismo de intersystem crossing (ISC) es favorable, lo cual está de acuerdo con los autores que proponen que la fotorreactividad de las furocumarinas se desarrolla a través del primer estado excitado triplete, tanto en el mecanismo Tipo II como en el mecanismo Tipo III. Por tanto, cabe esperar que un aumento en el rendimiento cuántico de formación del estado excitado triplete conduzca a un incremento de la acción fototerapéutica. Es la estructura electrónica del psoraleno lo que le confiere sus propiedades fototerapéuticas. Así, como todo estudio microscópico, es la Mecánica Cuántica la herramienta que tenemos que utilizar para elucidar y explicar las propiedades fisico-químicas de estos compuestos. De esta forma podemos justificar qué compuestos presentan mejores propiedades desde el punto de vista fototerapéutico, de acuerdo con los estudios mecanísticos comentados anteriormente: que la molécula presente un estado triplete que se pueble eficientemente a partir del estado excitado singlete, presente una vida media lo suficientemente larga como para poder interactuar bien con el DNA bien con el oxígeno molecular, que el fármaco sea inocuo en ausencia de radiación, que absorba a longitudes de onda largas (porque así la radiación incidente es dispersada en menor grado por los órganos y tejidos y podemos tratar zonas más internas del organismo), y que forme monoaductos y no diaductos (para evitar los efectos carcinógenos secundarios). Además, desde el punto de vista puramente químico- experimental, un buen fotosensibilizador debe ser anfifílico (precisa de una parte hidrófila para poder ser administrado por vía intravenosa, pero a la vez es necesaria una cierta hidrofobicidad para interaccionar con el DNA), fácilmente sintetizable con un grado de pureza adecuado y que sea eliminado rápidamente del organismo (para que no persista la fotosensibilización más de lo necesario, lo cual podría provocar graves quemaduras).
En la actualidad,el PDT es empleado para tratar diversos tipos de
cáncer: tumor de piel, cabeza y cuello, y de las mucosas de la
boca, esófago, estómago, vejiga y pulmón.
Muchos fármacos diferentes se han empleado para el PDT, pero el
Photofrin (porfimer sodium) es el único que ha recibido la
aprobación
oficial para su uso rutinario en pacientes. Se han empleado
eficazmente contra la psoriasis, aunque con el efecto adverso de
producir una fotosensibilización general del organismo durante
6-8 semanas que provoca que el paciente deba salir a la calle con un
atuendo protector, incluyendo gafas de sol.
Los investigadores están estudiando un nuevo fármaco, llamado "BPD verteporfin" para el PDT de cáncer de piel y psoriasis combinado con luz laser roja. El BPD no causa la prolongada fotosensibilidad que se le achaca al PHOTOFRIN.
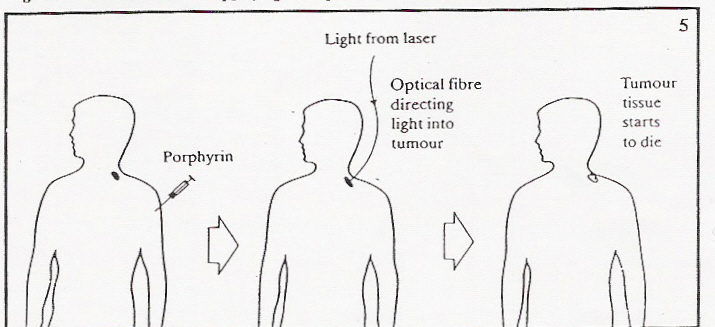
La luz lase empleada en PDT puede ser dirigida a un punto muy
interno del organismo mediante el empleo de la fibra óptica.
Mediante una sencilla intervención quirúrgica, el cable
de fibra óptica es situado cerca de la zona del tumor y
así es focalizada la luz, a través del cable, hasta el
tumor.
Una ventaja del PDT es que causa un daño mínimo al tejido sano.
Sin embargo, debido a que la luz laser actualmente en uso no puede
traspasar más de 3 cm de tejido, el PDT se emplea
principalmente para tratar tumores sobre la piel o justamente debajo
de la piel, amén de en las mucosas de órganos internos.
Por otro lado, la terapia fotodinámica para tratar la
degeneración macular asociada a la edad (DMAE) es muy eficaz,
ya que consigue mejorar o preservar la visión en muchos casos.
La mácula es la parte de la retina que permite al ojo ver
detalles finos en el centro del campo de la visión. La
degeneración se produce por una descomposición parcial
del epitelio pigmentario retinal (RPE por su sigla en inglés)
que es la capa aislante entre la retina y la coroides (la capa de
vasos sanguíneos detrás de la retina). El RPE
actúa como un filtro selectivo para determinar qué
nutrientes llegan hasta la retina desde la coroides. El RPE normal
mantiene alejados muchos componentes de la sangre que son dañinos para
la retina.
La descomposición del RPE interfiere con el metabolismo de la
retina causando su adelgazamiento (fase "seca" de la
degeneración macular). Estos elementos dañinos pueden
también promover la formación de nuevos vasos
sanguíneos y filtración de líquido
(fase "húmeda" de la degeneración macular).
Esta enfermedad produce únicamente pérdida de la
visión central y los campos visuales periféricos se
mantienen siempre. Aunque se puede generar pérdida de la
capacidad para leer y conducir como consecuencia de la
degeneración macular, la enfermedad no conduce a la ceguera
total.
La técnica, en concreto, se basa en la administración
del fármaco fotosensible verteporfina (Visudyne) que se acumula
selectivamente en el tejido neovascular de la retina. Posteriormente
es activado mediante la aplicación de un láser no
térmico que induce el cierre de los nuevos vasos evitando la
pérdida de visión.