Niels Bohr (1885-1962)
Nació el 7 de Octubre de 1885 en Copenhage, Dinamarca. Su padre, Christian Bohr, era profesor de fisiología en la universidad de esa ciudad, y era conocido por sus trabajos sobre los aspectos físicos y químicos de la respiración.
Su madre, Ellen Adler Bohr, era hija de un banquero y fue alumna de quien posteriormente sería su esposo. Niels Bohr y sus dos hermanos crecieron por tanto en una cálida atmósfera intelectual. Su hermano Harald se convirtió en un brillante matemático.
Bohr se distinguió en la universidad de Copenhage, donde obtuvo la medalla de oro del Royal Danish Academy of Sciences and Letters. En 1911 recibió su doctorado por su tesis sobre la teoría electrónica de los metales.
Fue entonces cuando partió hacia Inglaterra con la intención de continuar su trabajo con J. J. Thomson en Cambridge. Thomson nunca mostró especial interés por las ideas de Bohr sobre los electrones en los metales. En Marzo de 1912 Bohr se trasladó a Manchester, donde se incorporó al grupo de Rutherford en el que estudiaban la estructura del átomo.
Bohr regresó a Copenhage en el verano de 1912, donde se casó con Margrethe Norlund, y continuó desarrollando sus nuevas ideas sobre los átomos. La universidad creó para Bohr el Instituto de Física Teórica, que se inauguró en 1921, y donde Bohr trabajaría el resto de su vida. Éste se convirtió en un centro internacional del trabajo sobre el átomo y la teoría cuántica.
Bohr fue el primero en aplicar la teoría cuántica al problema d la estructura atómica y molecular. Por este trabajo recibió el premio Nobel de Física en 1922. Desarrolló la llamada teoría del átomo y el modelo del núcleo atómico líquido.
Modelo atómico de Bohr:
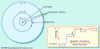
En 1913 Bohr propuso su modelo cuantizado del átomo para explicar cómo los electrones pueden tener órbitas estables alrededor del núcleo. Bohr se dio cuenta de que para construir un modelo atómico satisfactorio tenía que incluir de alguna manera el cuanto de energía de Planck-Einstein. Bohr resumió en varios puntos los supuestos que introdujo para explicar la constitución de su átomo, como resultado de aplicar los principios de Planck al átomo de Rutherford:
1) La energía no era emitida o absorbida en la forma continua que había supuesto la física clásica, sino solamente durante la transición de los electrones entre dos estados estacionarios.
2) Aunque el equilibrio de los átomos en el estado estacionario venía gobernado por las leyes ordinarias de la mecánica, dichas leyes no eran de aplicación en el paso de un estado estacionario a otro.
3) La radiación emitida era un cuanto de energía de Planck.
4) Los estados estacionarios venían determinados por la energía emitida y el giro del electrón.
5) El estado permanente de un átomo es en el que la energía emitida en su formación es máxima.
Bohr expuso sus ideas sobre el átomo en el artículo "On the constitution of atoms and molecules" en la revista Philosophical Magazine 26, 1-25 [ 1913]