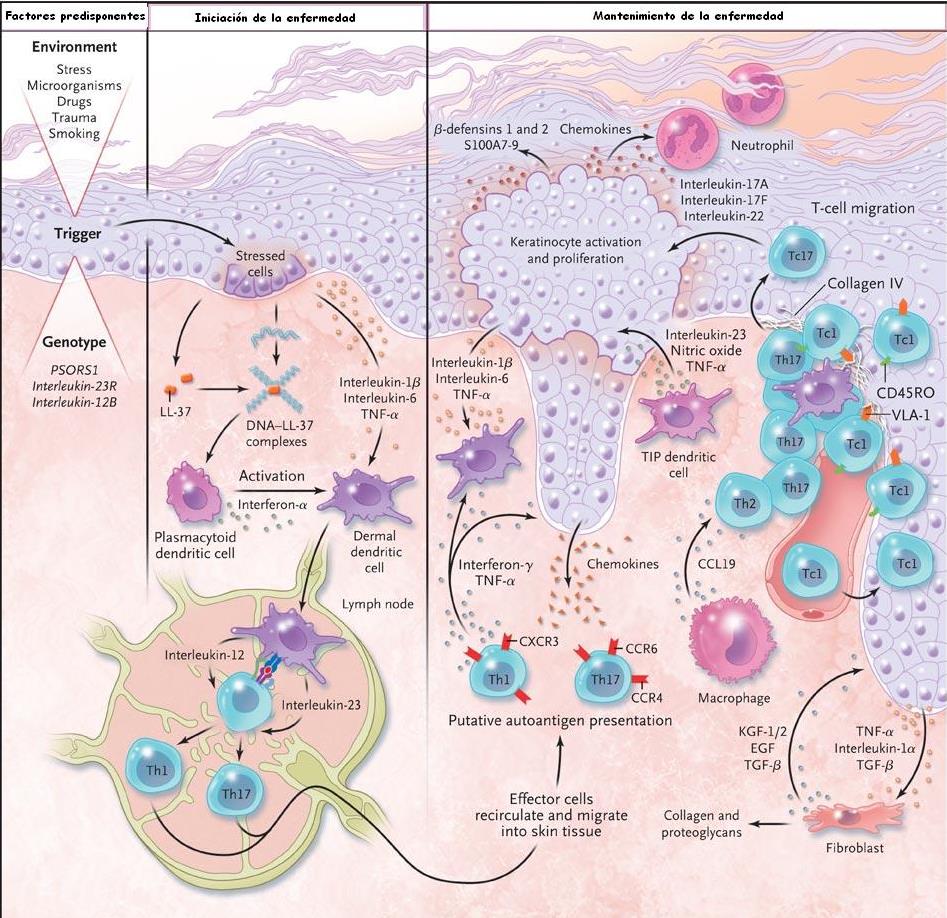
| Esquema de la evolución de una
lesión de psoriasis desde la iniciación hasta el mantenimiento de la
enfermedad.
La interacción entre los factores
medioambientales y geneticos proucen la situación de la iniciación de la
enfermedad. Los factores iniciales como los traumatismos físicos o
procutos bacterianos producne una cascada de situaciones que incluye la
formación de complejos LL-37-DNA, la activación de las células
dendríticas plamocitoies y la secreción de interferon-α. Las células
dendríticas mieloides activadas migran al ganglio linfático de drenaje e
inducen la diferenciación de células T indiferencidas hacia células
efectoras como las células T cooperadoras tipo 17 (Th17) y tipo 1 (Th1)
o células citotóxicas del tipo 1 (Tc1). Las células efectoras entran en
la recirculación y se enlente en en los capilares cutáneos en presencia
de las interacciones de ligangandos con las integrinas y selectinas. Las
células inmunes exprsando los receptores de quimiocinas CCR6, CCR4 y
CXCR3 emigran a la piel siguiendo un gradiente de citocinas. Los
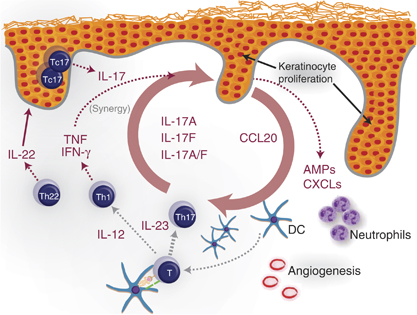
procesos clave en el manttemiento de la enfermedad son la presenctación
de autoantigenos posibles a las células T y la liberación de
interluecina-23 por parte de las células dendr´ticas dérmicas, la
producción de mediadores proinflamatorias como en factor de necrosis
tumoral α (TNF-α) y oxido nitrico por TNF-α y células dendríticas
inducibles de la producción de oxido nítrico, y la producción de
interleucina-17A, interleucina-17Fy enterleucina 11 por células Th17,
Tc17 y interferona-γ y TNF-α por células Th1 y Tc1. Estos mediadores
actúan en los ueratinocitos, dando lugar a la ctivación, proliferación y
producción de péptidos antimicrobianos (vgr: LL37 catelicidina y β-defensinas),
quimiocinas (vgr CXCL1, CXCL9 a CXCL11 y CCL20) y proteíns S100 (vgr
S100A7-9) por parte de los queratinocitos. Las células dendríticas y
células T forman grupos perivasculares y estrturas a tipo linfoide
alrededor de los basos en presencia de quimicinas como el CCL19
producida por los macrófagos. Un punto clave es la miración de células T
desde la dermis a la epidermis; esta migración se controla por medio de
la interacción de la α1β1 integrina(antígeno muy
tardío 1 (VLA-1) en las células T y en el colágeno IV de la memebrana
basal. Células T no convencionales, incluyendo célul ast natural
killer, contribuyen al proceso de la enfermedad. Cirucitos de
retroalimentación con la participación de quertinocitos,
fibrtoblasto y células endoteliales contirbuyen a la reorganización del
tejido con la activación de células endoteliales y la proliferación y
depósito de la matriz extracelular. Los neutrofilos en la epidermis son
atraidos por quimiocinas incluyendo la interlucina 8 (CXCL-8 y CXCL1.
nejm 361;5 2009 |