El azufre se presenta generalmente en forma de anillos S8 que se empaquetan en el sólido de formas diferentes,
dando lugar a cristales monoclínicos o rómbicos. Se conocen igualmente anillos de otros tamaños como S6 y S12.
El término de alotropía se ha usado tradicionalmente para designar las diferentes formas cristalinas
de los elementos, o formas alotrópicas. Para algunos autores,
[A.F. Wells, Structural Inorganic Chemistry, 5ª Ed, Oxford Science Publications], se trata de un
caso particular de polimorfismo. Otros [G. Rayner-Canham, Descriptive Inorganic Chemistry, W.H. Freman and Company] reservan el término
alotropía para formas cristalinas en las que unidades moleculares diferentes de la misma composición se empaquetan en formas
cristalinas diferentes, por ejemplo S6, S8 y S12, mientras que las formas rómbica y monoclínica de
S8 deben considerarse polimorfos. Otros textos [C.E. Housecroft y A.G. Sharpe, Inorganic Chemistry, Pearson-Prentice Hall] hablan en todos los casos de
alotropía.
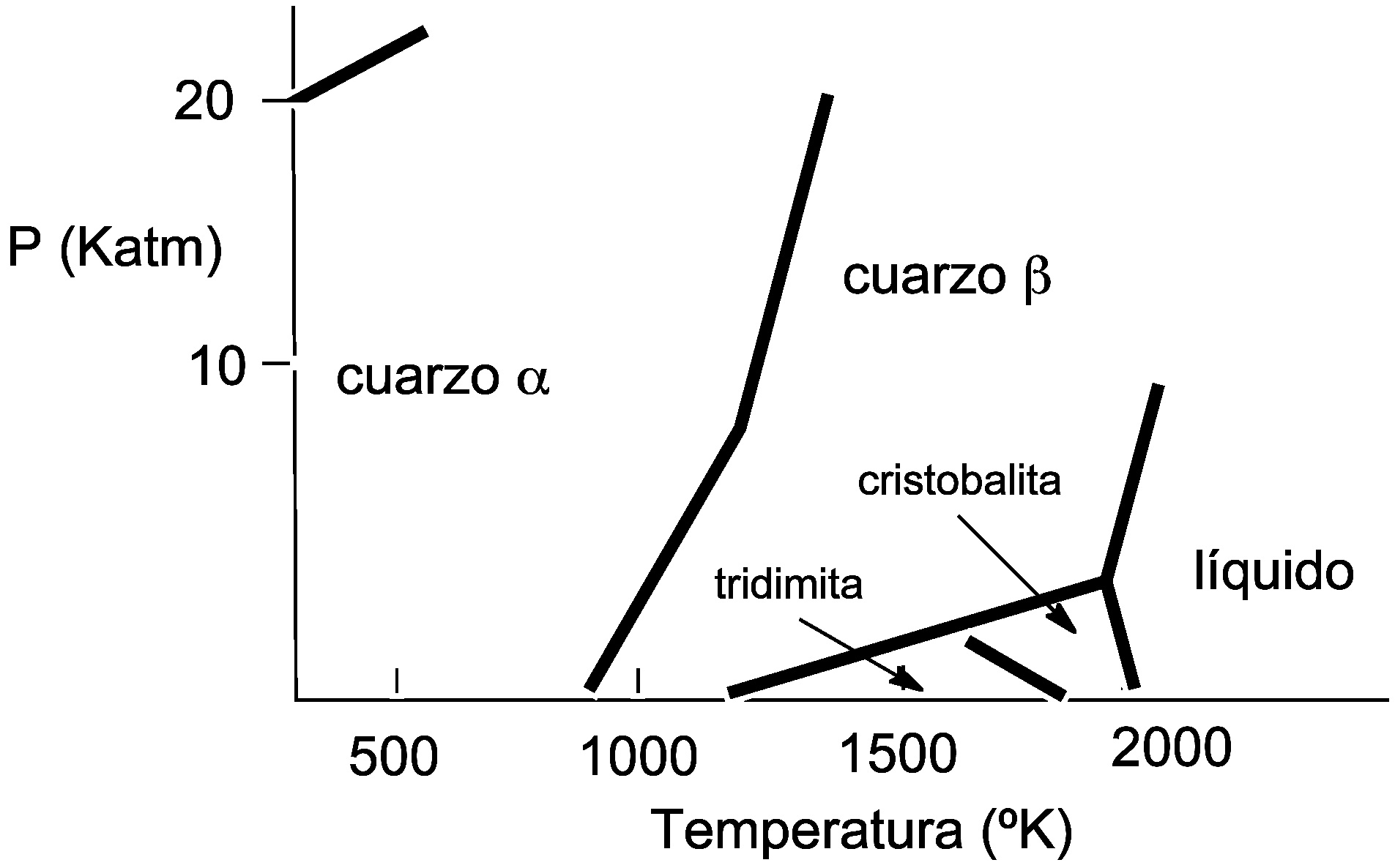
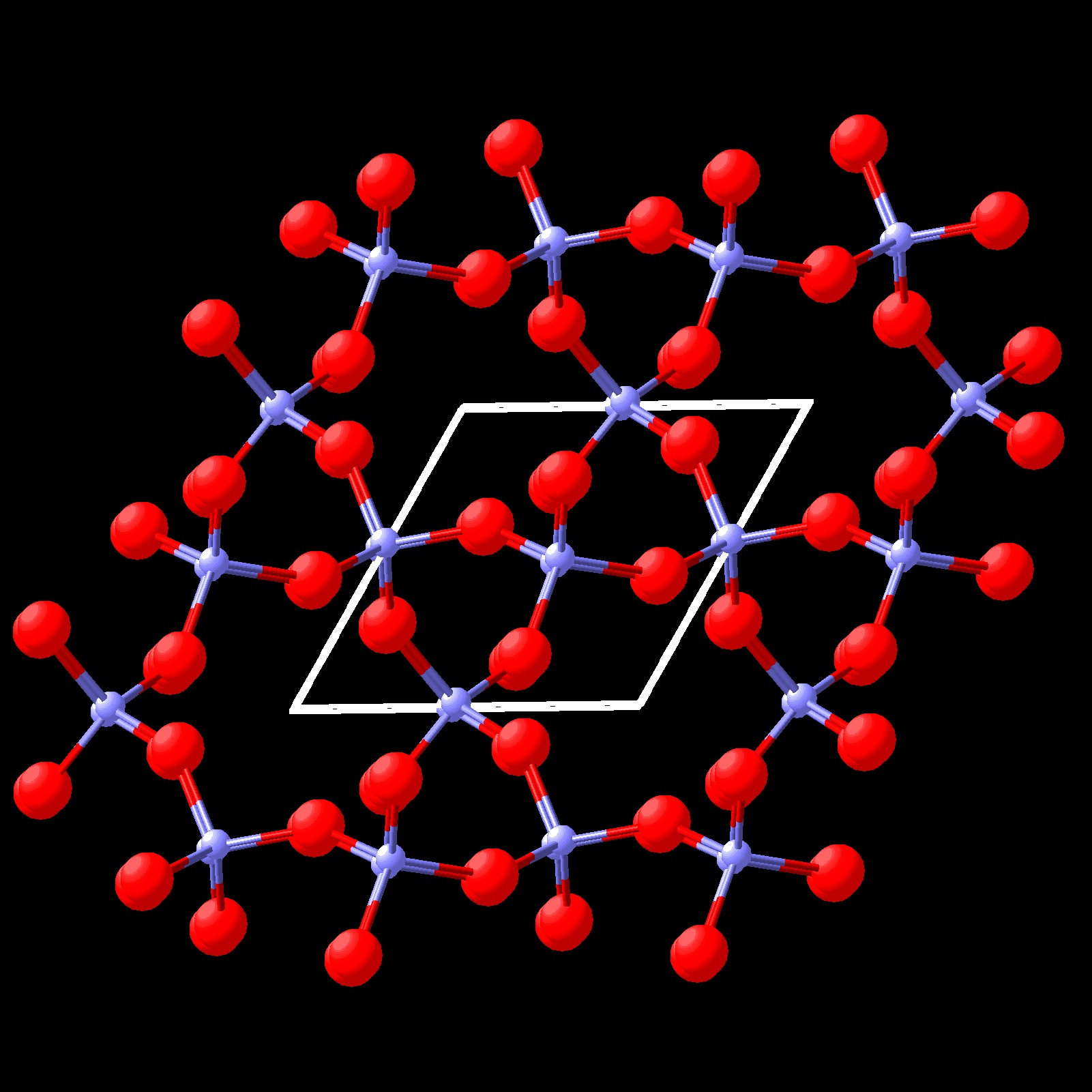
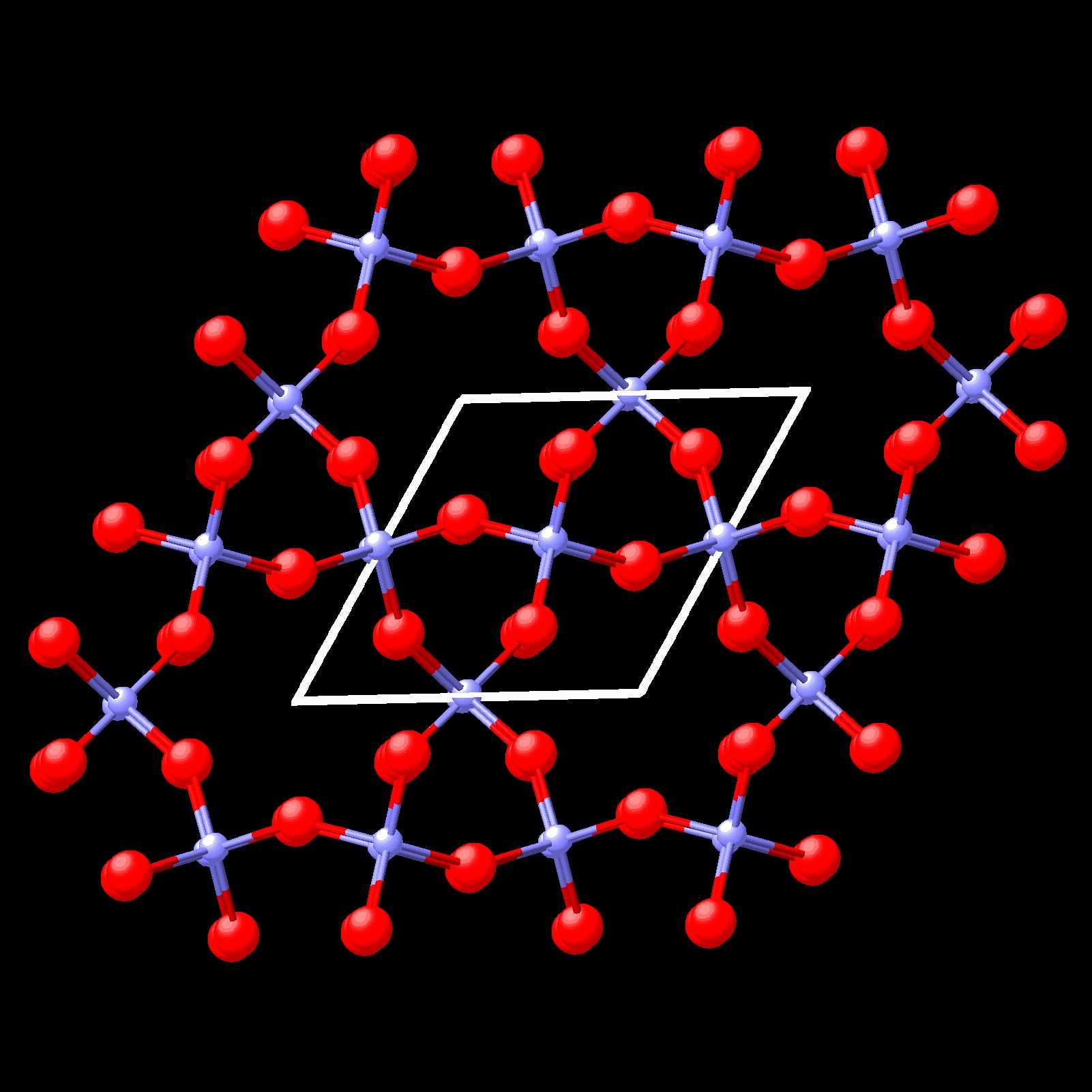
SiO2 presenta diferentes polimorfos. De ellos los más estudiados son cuarzo α , tridimita α o cristobalita α.
Las formas polimorfas pueden presentar solo ligeras diferencias en la ordenación de los
átomos. Tal es el caso de las formas α y
β de SiO2 cuarzo que se muestran en las figuras siguientes.
La forma:cuarzo α es la forma estable a baja temperatura y la forma cuarzo β es la forma estable a alta temperatura. Análogamente, cristobalita presenta dos formas
cristobalita α estable a baja temperatura y
cristobalita β de alta temperatura.
Si las observamos con detalle, el paso de una a
otra de las estructuras supone solo ligeros cambios en los ángulos Si-O-Si. Por ello la transición entre ellas
ocurre con facilidad a una
temperatura relativamente baja, 570ºC a presión normal.
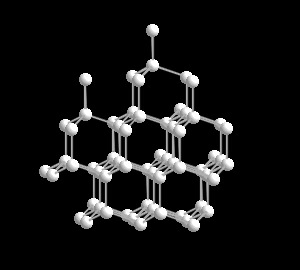
En algunos casos las formas polimórficas son estructuralmente
muy diferentes entre sí. Tal es es caso del carbono que tiene las variedades de diamante, grafito y fullereno.
diamante.
grafito.
c60
Otros elementos que presentan polimorfismo:
azufre monoclínico
que es la forma estable a baja temperatura y
azufre ortorrómbico
estable por encima de 95.5ºC, ambos constituidos por anillos S8 empaquetados de forma diferentes en el cristal.
Aunque menos estables, azufre tambien forma anillos de diferentes tamaños.
Como ejemplos tenemos:
azufre S6 o
azufre S10
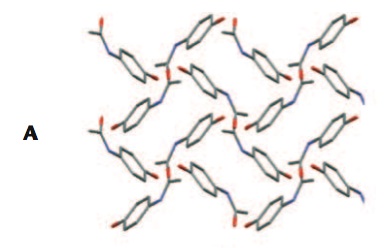
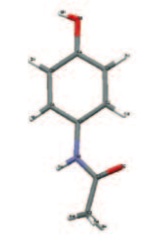
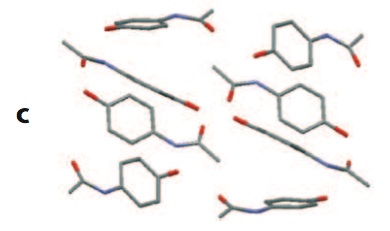
El tema de los polimorfos es especialmente importante en los fármacos. Determinados polimorfos
pueden presentar propiedades que les haga indeseables, bien por su diferencia de solubilidad o
cualquier otra propiedad. Se conocen al menos dos
polimorfos de Paracetamol, que se diferencian en el modo de empaquetamiento de las moléculas en el sólido.
 |
 |
 |
Al Indice