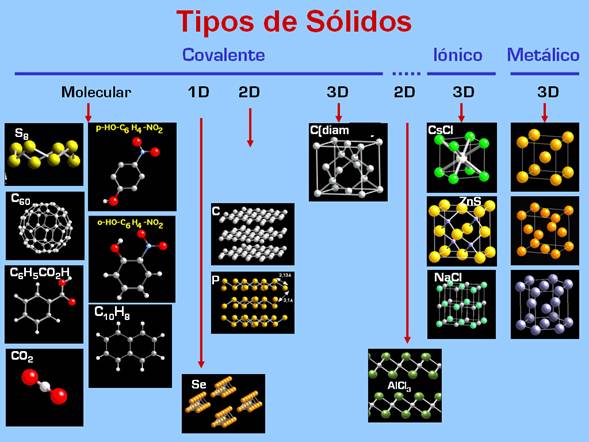
Tipos de sólidos.
Tema 3. Clasificación de los sólidos
3.1.Tipos de sólidos
Al Indice


La gran mayoría de los elementos y compuestos químicos, especialmente los
compuestos inorgánicos, son sólidos en condiciones normales. Existe una relación bastante directa
entre el tipo de enlace y la estructura del sólido.
La siguiente figura muestra
ejemplos de diferentes tipos de sólidos.
Resulta muy difícil
resumir en una única tabla la gran variedad estructural existente. Dado que existen numerosos
compuestos con enlaces intermedios entre covalente/iónico/metálico resulta útil hacer una
clasificación de los sólidos en base a razones estructurales.
Clasificación por geometría.
Sólidos moleculares. Están formados por unidades discretas, moléculas,
que contienen átomos de uno o varios elementos unidos por enlaces covalentes. En el cristal la
moléculas se empaquetan entre sí mediante fuerzas de Van der Waals, generalmente relativamente
débiles. La mayoría de los sólidos orgánicos son moleculares, por ejemplo
naftaleno.
Algunos elementos no metálicos forman sólidos moleculares.
Como ejemplo tenemos
azufre,
una variedad de carbono
fullereno y
yodo.
Mas adelante veremos otros ejemplos de sólidos inorgánicos moleculares.
Sólidos 1D. Un ejemplo de sólido con estructura en cadenas es
selenio.
Los enlaces entre los átomos se orientan en una dirección formando cadenas que se empaquetan
en el cristal mediante fuerzas de Van der Waals. Sólidos de este tipo son poco frecuentes.
Podemos incluir dentro de este grupo algunos compuestos iónicos tales como un silicato de
fórmula K2ZnSi2O6. La estructura de este silicato consiste en
cadenas de tetraedros
SiO4 que comparten dos vértices. Las cadenas con carga negativa, se apilan en el cristal con los
cationes K y Zn
compensando las cargas, se sitúan entre las cadenas.
Sólidos 2D. Se
caracterizan por tener enlaces entre átomos dirigidos en dos de las tres direcciones, formando capas.
El ejemplo frecuentemente mencionado de sólido con estructura en capas, es el
grafito
con enlaces covalentes puros. Esta estructura también la adoptan compuestos con enlace intermedio
entre ionico y covalente como
AlCl3. Lo característico de estos sólidos es la existencia de distancias cortas en
dos direcciones, dentro de las capas, y apreciablemente mayores en la tercera dirección, entre capas.
Este tipo de estructuras no es frecuente entre los compuestos orgánicos.
Sólidos 3D.
Los enlaces se orientan en las tres direcciones del espacio. Dentro de este grupo encontramos tanto compuestos
covalentes como iónicos y metálicos. La diferencia entre ellos está en el modo de empaquetamiento de
los átomos o iones en la red, lo que se refleja en el I.C. de los átomos o iones.
Un ejemplo de solido covalente tridimensional es
carbono diamante
o tambien
carburo de silicio.
Los ejemplos de sólidos tridimensionales iónicos o metálicos se pueden encontrar en
sólidos iónicos.
o
redes metálicas
se encuentran mas adelante.
Al Indice