7.1. Elementos.
Vamos a resaltar los cambios estructurales de elementos representativos.
 |
 |
 |
 |
 |
 |
 |
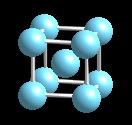
De Li a Iodo, las propiedades y la estructura de los elementos varían de típicamente metálicas, Li,Be, a no metálicas los restantes.
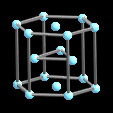
El carácter metálicos de los elementos aumenta al descender en el grupo. La estructura de los elementos varía de manera paralela a este cambio de propiedades. Esto se observa de modo mas claro en los grupos intermedios 13-16 en los que los elementos mas ligeros tienen comportamiento no-metálico y los mas pesados tienen carácter metálico.Mientras la estructura de boro es típicamente no metálica, la de aluminio es típicamente metálica y mas compacta y finalmente la de talio es hexagonal compacta.
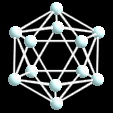
Los elementos mas ligeros del grupo, C, Si Ge y Sn presentan la estructura tipo C diamante. Las distancias de enlace X-X aumentan con el número atómico, desde 1.544A en carbono a 2.810A en estaño. Para C, Si y Ge ésta es la estructura termodinámicamente más estable. La forma estable de estaño es algo mas irregular. La estructura de plomo es cúbica compacta, de acuerdo con su carácter metálico.
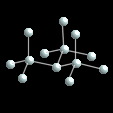
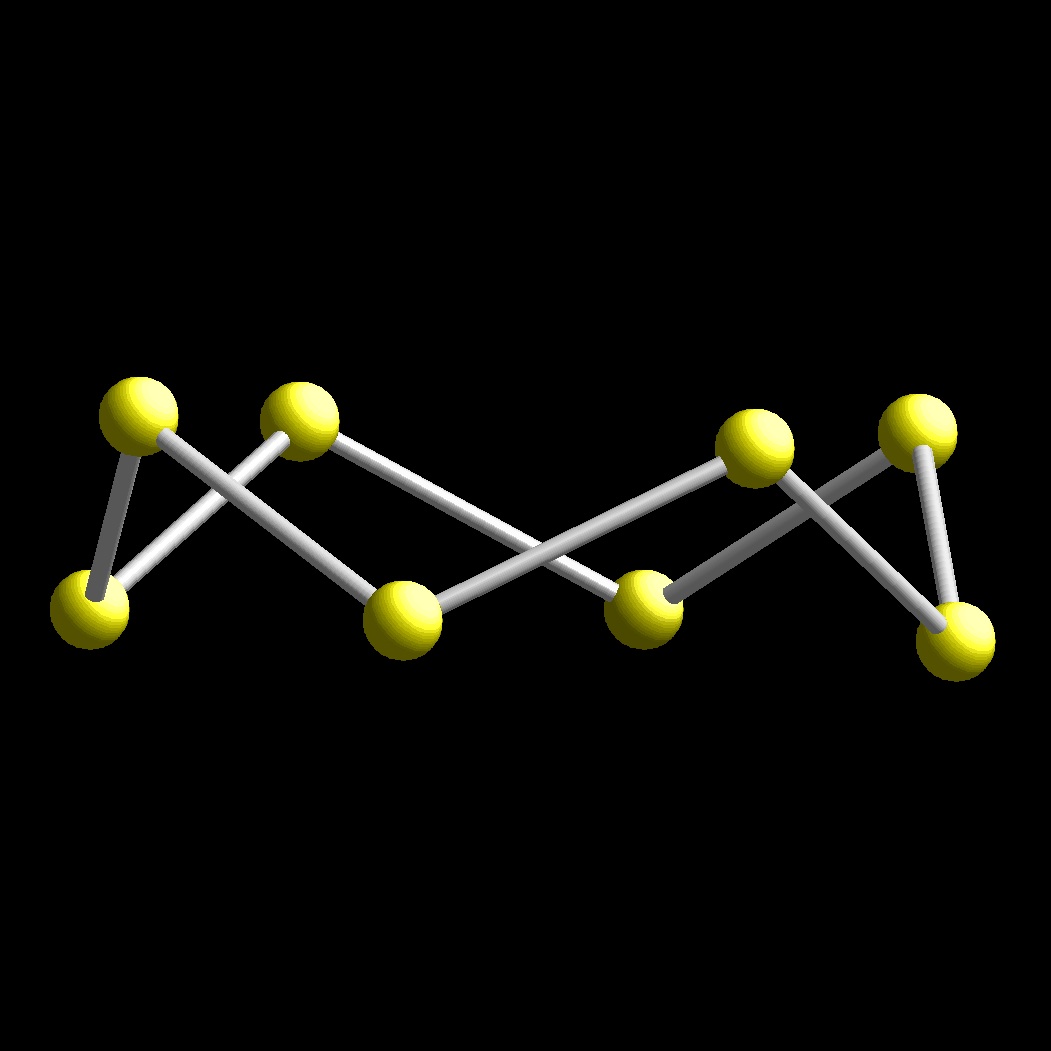
Además de nitrógeno, fósforo presenta una variedad molecular, P blanco, P4, muy reactiva. Ademas hay dos variedades, fósforo rojo y P negro, obtenidas por calentamiento a presión de P blanco.
P negro presenta dos variedades en capas, fósforo ortorrómbico y la variedad fósforo romboédrico.
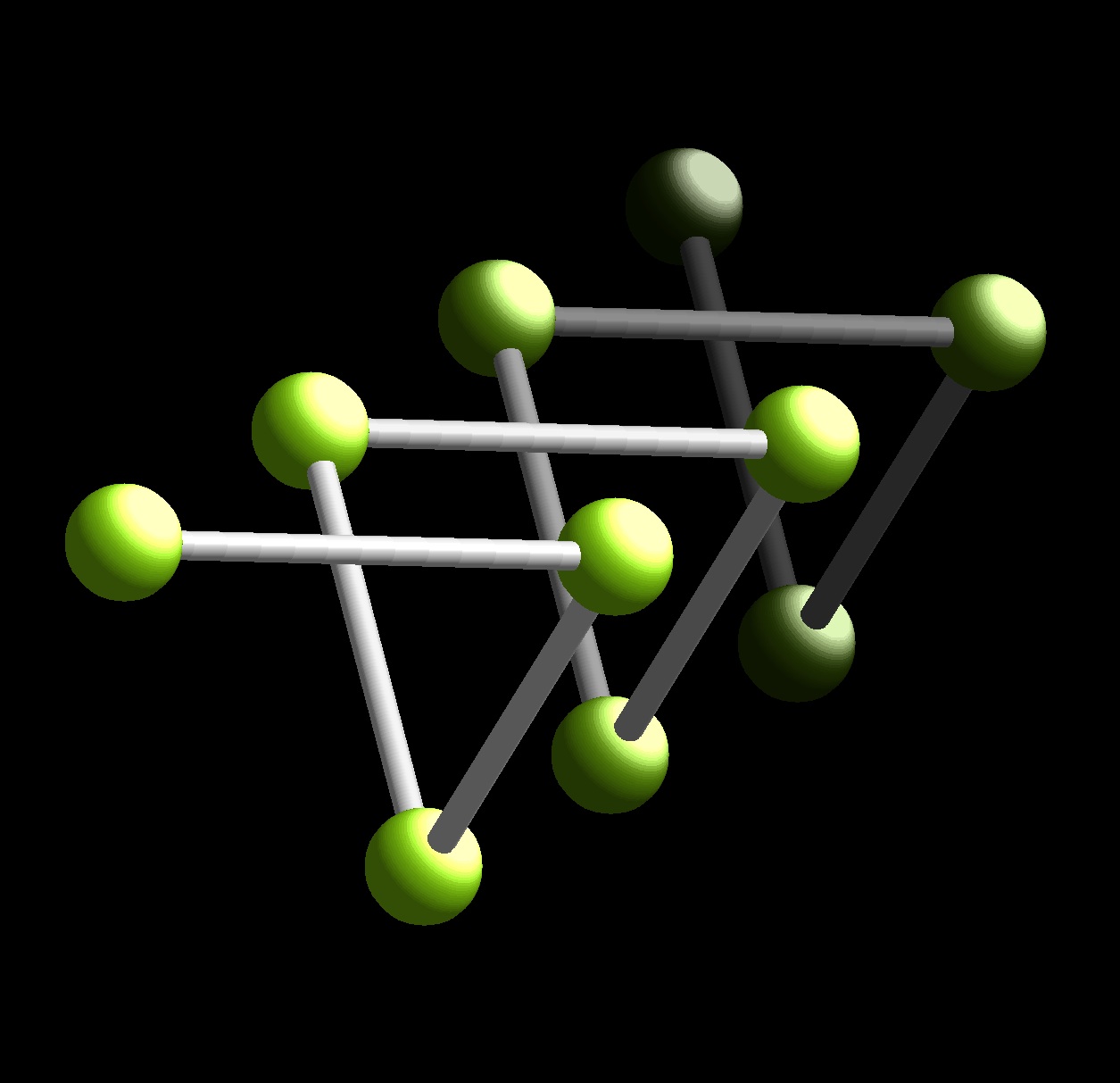
Se han descrito las variedades arsénico romboédrico y antimonio romboédrico ambas similares a la de fósforo.
Bismuto presenta diversas variedades, bismuto romboédrico y una variedad de I.C. 8, tipo CsCl, a elevada presión.
En este grupo de elementos podemos observar que la relación de distancias X-X dentro de una capa y entre capas se hace cada vez mayor. En P este valor es de aproximadamente 0.75 miemtras que en Sb y Bi 0.87.
 |
 |
 |
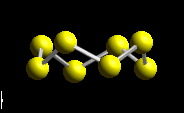
Azufre presenta las variedades azufre monoclínico y azufre ortorrómico como las mas estables. Se han descrito otras variedades de azufre formadas por anillos de 6,7,11-14, 18 o 20 átomos de azufre.
Selenio y tambien teluro adoptan estructuras en cadenas. Polonio adopta una estructura cúbica simple y otras con I.C.6.
Actividad. Haz un resumen del contenido del tema. Resalta la relación entre estructura de un elemento, posición en la tabla periódica y carácter metálico/no metálico.
Al Indice