
Sólidos
covalentes bidimensionales.
Dentro de este
grupo se incluyen aquellos sólidos en los que los átomos se
encuentran unidos por enlaces covalentes o covalentes con cierta polaridad,
orientados
en dos dimensiones. Las capas así formadas se unes entre si por fuerzas
de Van der Waals.
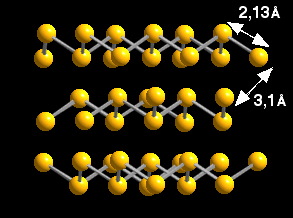
El ejemplo más representativo de este tipo de sólidos lo constituye el carbono grafito. Otro ejemplo de este tipo de estructura es el fósforo romboédrico.
 |
 |
|
C
grafito
|
P
negro romboédrico
|
Observad que en estos sólidos se puede ver que las distancias de enlace entre átomos dentro de una capa, unidos por enlaces covalentes, son menores que las distancias entre átomos de diferentes capas, unidos por enlaces de Van der Waals.
Observad la diferente estructura de estos dos elementos. C y P utilizan tres electrones para formr tres enlaces covalentes con otros tres átomos. El cuarto electrón en Cgrafito se encuentra formando un enlace p deslocalizado en cada capa que refuerza el enlace sigma. En fósforo, el par electrónico restante fuerza a una geometría piramidal de cada átomo.