

Sólidos
moleculares.
Estan formados por moléculas que son unidades discretas compuestas por uno
o más átomos iguales o diferentes, que se empaquetan
en el sólido. Los enlaces entre los átomos
dentro de cada molécula
son enlaces covalentes con más o menos carácter polar. Las
moléculas
estan unidas por débiles fuerzas de Van der Waals.
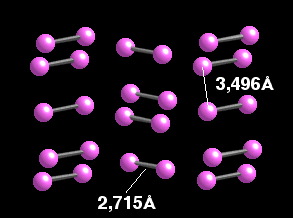
Las distancias entre átomos unidos por enlace covalente, distancias
intramoleculares,
son más cortas que las que existen entre átomos de diferentes
moléculas, distancias intermoleculares.
Al pasar a la fase líquido o gas, las moléculas permanecen y solo
se rompen las fuerzas intermoleculares.
Algunos ejemplos
de sólidos moleculares. Pasar el cursor por las siguientes figuras para
ver la unidad estructural.

|
 |
|
Iodo
|
Fósforo
blanco
|
 |
 |
|
Benceno
|
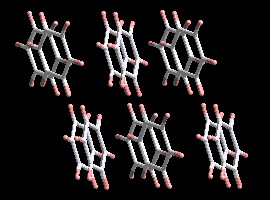
Acido
benzóico
|
La mayoría de los compuestos orgánicos forman sólidos moleculares.
En la estructura del ácido benzóico, C6H5-COOH, además de las fuerzas de London existen enlaces por puentes de hidrógeno C=O....H-O. Estos enlaces, algo más fuertes que las fuerzas de Van der Waals, hacen que las moléculas del ácido benzóico se ordenen en el sólido por parejas, formando enlaces por puente de hidrógeno intermoleculares. Esta interacción es suficientemente fuerte y se mantiene cuando el ácido benzóico se disuelve en disolventes no polares como benceno.