| Tema 2.1. Estructura atómica. Modelos atómicos clásicos |
Bibliografía, Petrucci, Tema 9.
Conceptos.
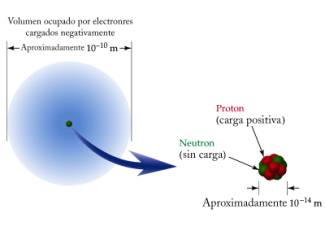
- La materia está compuesta por átomos que son eléctricamente neutros.
- Durante finales del siglo XIX y comienzos del XX se descubrieron las partículas subatómicas.
Protones. M= 1.67x10-27 Kg ; Q = (+)1.60 10-19 Culomb
Neutrones. M= 1.67x10-27 Kg. Q = 0.
Electrones. M= 9.11x10-31 Kg ; Q = (-)1.60 10-19 Culomb
- Los modelos atómicos trataron de describir el comportamiento de los átomos. Había partículas con cargas diferentes que, sorprendentemente no se atraen.
- Modelo de Rutherford: los átomos constan de un núcleo y corteza electrónica.
- Radiación electromagnética: Una forma de tranmisión de la energía. Campos eléctricos y magnéticos se propagan por ondas a través del espacio.
- Características de las ondas: Amplitud: altura de la cresta. Longitud de onda (l) : distancia entre dos máximos(L). Frecuencia (n): número de crestas que pasan por segundo(T-1). Velocidad c = l.n = 299792500 m.s-1., aprox 300.000 Kms-1.
- Otra caracteristica de las ondas : las interferencias.
- Radiación monocromática: Solo tiene una longitud de onda.
- Espectros electromagnéticos: Descomposición de una radiación electromagnética en las diferentes longitudes de onda
- Orden de longitud de onda: Rayos g < Rayos X<UV<visible<IR<microondas<radiofrecuencias
- Espectro de líneas. La radiación contiene un reducido número longitudes de onda. El hidrógeno y diversos átomos metálicos cuando se excitan emiten una radiación que tiene un espectro de líneas.
- Rydberg escribió la expresión n = k (1/22 -1/n2 ) donde n= 3,4, . que clasifica el valor de la frecuencia para las líneas del espectro de H en el visible (Serie de Balmer)
- Espectro continuo. La radiación contiene todas las longitudes de onda dentro de un amplio rango.La luz blanca tiene un espectro continuo.
- Teoría cuántica. Planck: La energía, como la materia , es discontínua.
- Cuantos de radiación E = hn. Frecuencia mayor, energía mayor del cuanto.
- Efecto fotoeléctrico. La luz, al chocar
sobre un metal puede emitir electrones.
- Ello ocurre solo si la frecuencia de la luz es mayor que un valor n0, característico del metal.
- El número de electrones emitidos depende de la intensidad de la luz.
- La energía cinética de los electrones emitido depende de la frecuencia de la luz.
- Modelo de Bohr.
- El electrón describe orbitas circulares alrededor del núcleo.
- Solo algunas orbitas estan permitidas: estados estacionarios (EE).
- Momento angular del electrón (mvr) está cuantizado mvr =nh/2p.
- n es el número cuántico principal. n = 1,2,3.....
- El electrón en un EE tiene energía constante. E = -RH/n2 . RH= 2.179.10-18 J. Se dice que electrón tiene su energía cuantizada..
-
n= infinito
E= 0
El electrón se separa del núcleo. Se forma ión H+.n=3 E= - RH/9 n=2
E= - RH/4 n=1 E= - RH - Un electrón puede pasar de un ee a otro. En este proceso se absorbe o emite un cuanto de luz de energía definida. E = hn = diferencia de energía entre los ee.
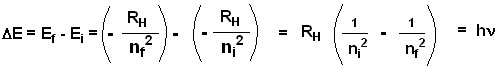
- La energía de ionización del H es E = RH .
- Al calentar o someter a descargas una muestra de H, el electrón pasa del nivel fundamental a niveles excitados, de más alta energía.
- El electrón excitado puede caer a niveles de energía mas bajos; lo hacen con desprendimiento de una radición.
- La radiación emitida tiene una energía, E= hn, igual a la diferencia de energía entre los estados inicial y final.
- La radiación emitida es discontinua ya que el electrón en el átomo solo puede tomar determinados valores de energía.
- Un electrón fuera del átomo no tiene la energía cuantizada. Puede tomar cualquier valor de energía.
- Bohr no explica los espectros de los átomos polielectrónicos.
- Experimentalmente se introducen nuevos números cuánticos empiricos, l y ml nuevos nº cuánticos.
- La Mecánica Clásica no explica bien los sistemas microscópicos.
- La Mecánica Clásica es Determinista.
- Los estudios de espectroscopia atómica en diferentes condiciones indicaron que la interpretación de los niveles de energía permitidos para los electrones en átomos polielectrónicos requiere tres números cuánticos, . n , l , ml.
- Reglas de selección.
n = 1, 2, 3, n Nivel principal l = 0, 1, 2,…(n-1) Subnivel ml = l, ( l-1),…2, 1,0, -1, -2, ….-l Orbital