|
4.1.Modelo
de enlace covalente localizado. |
- Los átomos no se encuentran generalmente aislados en la naturaleza.
- Los átomos se combinan entre sí formando sistemas más estables.
- Unión de átomos iguales da los elementos
- Unión de átomos diferentes da los compuestos.
- Las uniones entre átomos se denominan enlaces químicos.
- Existen diferentes tipos de enlaces químicos que dan lugar a compuestos con propiedades diferentes.
- En todos los enlaces químicos participan los electrones más externos de los átomos (electrones de valencia).
- La estructura, tipo de enlace y distribución de los electrones determina las propiedades de los compuestos.
- Los tres tipos fundamentales de enlace químico son : covalente, iónico y metálico. Muchas situaciones reales de enlace son intermedias entre estas tres situaciones ideales o límite.
- Teoría de Lewis.
- Los electrones de valencia participan
en el enlace.
- Dos átomos comparten uno o mas pares electrónicos
formando enlaces covalentes.
- Un átomo transfiere electrones a otro formando
enlaces iónicos.
- El número de electrones que rodea a un átomo
en un compuesto se denomina número atómico efectivo (NAE).
- Los átomos con n=2 tienden a adquirir NAE =8
(octeto).
- Los átomos con n>2 amplían a veces
el octeto.
- Las estructuras de Lewis se utilizan fundamentalmente
para compuestos covalentes.
- Enlaces covalentes.
- Enlace covalente: compartición de un par electrónico.
- Compartiendo pares electrónicos los átomos tienden a NAE =8.
- Dos átomos comparten un par electrónico, enlace covalente sencillo
- Cada átomo aporta un electrón : enlace covalente “normal”
- Un átomo aporta los dos electrones : enlace covalente “dativo” o “coordinado”.
- Dos átomos comparten dos pares electrónicos, enlace covalente doble.
- Dos átomos comparten tres pares electrónicos, enlace covalente triple.
- Los pares compartidos entre átomos se denominan pares de enlace.
- Los que sólo pertenecen a un átomo se denominan pares solitarios.
- Polaridad de los enlaces.
- Los enlaces entre átomos iguales o de igual electronegatividad son enlaces no polares. El par electrónico está compartido por igual por los dos átomos.
- Los enlaces entre átomos de diferentes electronegatividad son enlaces polares. El par electrónico no se encuentran compartido de igual modo por los dos átomos.
- Obtención de estructuras de Lewis. Compuestos ABn
- Existe el átomo central unido
a dos o mas átomos.
- Los átomos restantes son terminales.
- Los átomos de hidrógeno
son siempre terminales.
- El átomo central suele ser el de menor electronegatividad.
- Obtención de estructuras de Lewis. Compuestos XOmHn
- Un átomo central X unido a “m”
átomos de oxígeno.
- “m” vale 3, 4 o 6 generalmente.
- Existen enlaces X-O-H
- En algunos casos pueden verse enlace X-O-O
(grupos peroxo)
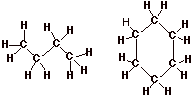
- Obtención de estructuras de Lewis. Compuestos de carbono.
- Existen diversos átomos de carbono
centrales
- Cada átomo de C unido a otros C,
H. (Hidrocarburos)
- Los compuestos forman cadenas o ciclos.
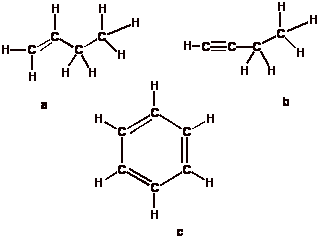
- Existen hidrocarburos con solo enlaces
sencillos, (saturados) y otros con enlaces múltiples C-C (insaturados).
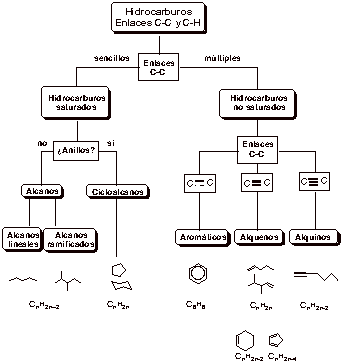
Clasificación de los hidrocarburos.
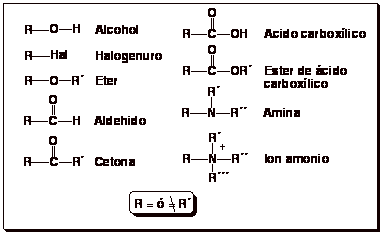
- Los radicales orgánicos R, son hidrocarburos
a falta de un hidrógeno. Son útiles a efectos de nomenclatura
esquemática. Ej: R-OH equivale a
- CH3-OH, CH3-CH2-OH
etc
- Existen frecuentes agrupaciones de enlaces:
Grupos funcionales. Tiene propiedades químicas características
de cada grupo. Algunos de los grupos funcionales mas importantes son: