
NÚMERO

NÚMERO
INFLUENCIA DE LA ANATOMÍA TOPOGRÁFICA EN LA DESINFECCIÓN DE CONDUCTOS RADICULARES.
Dr. Pablo SPOLETI: Jefe de Trabajos Prácticos Ordinario.§ Larrechea 724. (2000) Rosario, ARGENTINA. e-mail: pspoleti@citynet.net.ar
Dra. Martha SIRAGUSA: Profesora Titular Ordinaria.§ Mitre 465 8º A (2000) Rosario, ARGENTINA.
§ Cátedra de Endodoncia. Fac. de Odontología, Universidad Nacional de Rosario-Argentina
INTRODUCCION
La Endodoncia, rama de la Odontología que se ocupa del estudio, prevención y tratamiento de las afecciones pulpares y de sus efectos en el periápice, ha obtenido un gran éxito en la recuperación de piezas dentarias afectadas, permitiendo que éstas sean devueltas a su función y estética específicas.
La patogenia de la pulpa dental y de los tejidos periapicales depende en gran medida de las bacterias, por lo que es necesario el conocimiento de las situaciones que permiten a los microorganismos sobrevivir o perecer dentro del sistema de conductos radiculares y su medio, y así mejorar el criterio clínico en el tratamiento de las infecciones pulpares y de las regiones de influencia.
Son muchas las barreras con las que se topan las bacterias como agentes cuya acción culmina en una infección franca, sin embargo, es posible que las transgredan. Las propiedades especiales de los microorganismos infectantes pudieran ser el factor determinante en el “destino” de los tejidos vivos, y también influyen en la modalidad del tratamiento que se escoja.
La cámara pulpar y los conductos radiculares de los dientes sin vitalidad y no tratados están ocupados por una masa gelatinosa de restos pulpares necróticos y líquido hístico, porciones de tejido momificado, y tejido vivo que se encuentra algunas veces en la porción apical del conducto radicular. Por lo general también hay bacterias. Un instrumento proyectado hacia dicho conducto puede hacer salir este material nocivo a través del foramen apical, y producir inflamación o infección periapical o ambas a la vez. (1)
En 1890 Willoughby Miller publicó el libro "Microorganismos de la boca humana", que llegó a ser la base de la microbiología odontológica en Estados Unidos. Cuatro años más tarde se convirtió en el primer investigador en identificar bacterias en la pulpa enferma.(2)
Desde entonces la mayoría de los trabajos que investigaron la flora de los conductos radiculares infectados han comunicado la presencia de numerosas bacterias. Los géneros predominantes fueron estreptococos y micrococos; se ha demostrado también la existencia en conductos radiculares infectados de bacterias anaerobias, con prevalencia de bacilos Gram negativos, y de anaerobios facultativos. El tipo y la cantidad de microorganismos aislados varía en forma considerable de acuerdo al medio de cultivo y las técnicas de identificación bacteriana utilizada.(3,4,5,6,7,8,9,10,11)
La vía de invasión más común es la contaminación por los gérmenes de la cavidad oral, que penetran en el conducto radicular a través de una lesión cariosa. Los gérmenes anaerobios se refugian en el surco gingival y en la placa, por lo que cualquier microorganismo de la flora oral puede, en teoría, infectar el conducto.
El tercio apical del conducto radicular provee a los microorganismos un ecosistema ideal para su crecimiento y desarrollo; pudiendo generarse en muchos casos condiciones de anaerobiosis. Los restos orgánicos proveen el sustrato necesario para este desarrollo bacteriano. El granuloma periapical es la manifestación defensiva del organismo a la infección, para tratar de limitarla. (12)
El conocimiento minucioso de la morfología interna de las piezas dentarias es fundamental para lograr la limpieza y conformación del sistema de conductos radiculares. Aunque es incuestionable como acompañante el examen radiográfico, el operador deberá desarrollar su sensibilidad táctil para a través de la misma descubrir mentalmente la configuración interna de tan variada topografía.
Para el éxito tanto a corto como a largo plazo, el debridamiento minucioso de la cámara pulpar y los conductos constituye un aspecto fundamental del tratamiento endodóntico. Por esta razón, antes de la instrumentación y a intervalos frecuentes durante ella, los conductos deberán irrigarse con una solución que permita desinfectar y disolver el material orgánico. Además de la acción de debridamiento, la irrigación facilita la instrumentación, ya que lubrica las paredes de los conductos y suspende las limallas dentinarias. (13)
La diversidad en la anatomía topográfica, tanto en lo macroscópico como en lo microscópico, de las distintas piezas dentarias sumada a la compleja variabilidad del sistema de conductos exigen la evaluación de las técnicas de preparación químico-bio-mecánica en cuanto a su eficacia en la desinfección del sistema.
MATERIALES Y METODOS
Se realizó un estudio comparativo para analizar la eficacia de la desinfección del sistema de conductos radiculares en piezas dentarias de diferente topografía, para ello se seleccionó una muestra representativa de piezas dentarias, sin tener en cuenta edad ni sexo del paciente, con diferente anatomía topográfica en los conductos radiculares.
Fueron divididas en 3 grupos: GRUPO A: 40 incisivos centrales superiores, GRUPO B: 40 caninos superiores, y GRUPO C: 40 raíces distovestibulares de 1º molar superior.
Estas piezas dentarias fueron elegidas luego de diagnosticar la vitalidad de las mismas, mediante tests térmicos, antes de ser extraídas. Posteriormente fueron lavadas con solución fisiológica estéril y conservadas en el mismo medio, para evitar cualquier efecto de soluciones fijadoras. Se esterilizaron, por razones de bioseguridad, en autoclave a 131ºC durante 30 minutos (según recomendación del Centro de Control de Infecciones de Atlanta Estados Unidos C.D.C.)(14,15) para ser nuevamente almacenadas en solución fisiológica estéril hasta el momento de ser utilizadas en la experiencia.
La superficie externa de los dientes fue limpiada con la ayuda de una pieza de mano ultrasónica para periodoncia. Se realizaron surcos guía a nivel amelo cementario, y por vestibular y palatino en incisivos y caninos y en la raíz distal de los primeros molares superiores, para la posterior separación de la porción coronaria y segmentación de las raíces longitudinalmente. Para facilitar el corte de la raíz disto vestibular del primer molar superior se amputó la raíz mesio vestibular.
Se efectúo la cavidad de apertura de las piezas dentarias luego de la eliminación total de caries y obturaciones previas. Realizada la extirpación pulpar con tiranervios se determinó la longitud de trabajo del conducto con una lima lisa nº 6 u 8.
Los conductos fueron permeabilizados para garantizar la penetración del inóculo, hasta una lima nº 20 irrigando con 5 ml de agua estéril durante esta maniobra. Se selló el ápice radicular montando las piezas dentarias en tacos de acrílico autocurable.
Los dientes fueron entonces esterilizados en autoclave durante 15 minutos a 120 ºC antes de la inoculación. Después de este procedimiento se trabajó con una técnica aséptica (guantes estériles, instrumentos esterilizados, etc.) Antes de ser inoculados, los conductos radiculares fueron secados con conos de papel absorbente estéril y la superficie externa con gasa estéril.
Se preparó un inóculo con los siguientes gérmenes Staphylococcus aureus, Escherichia coli y Streptococcus viridans, en el que se contaron aproximadamente 187 colonias de cada uno de los gérmenes. Diez microlitros de una suspensión 0,5 de la escala de Mc Farland (equivalente a 1,5 x 108 unidades formadoras de colonias por ml) de cada uno de los microorganismos fueron mezclados y centrifugados para precipitar las células (durante 5 minutos a 2000 RPM), resuspendiendo ese precipitado en 2.0 ml de caldo tripticasa soja logrando así un inóculo con montos medidos de gérmenes tipificados.
Basándose en esta fórmula se prepararon 300 ml de inóculo, los cuales fueron fraccionados en quince frascos (de 20 ml cada uno), sellados a presión y llevados a freezer hasta el momento de su utilización.
Se cultivó una anzada del inóculo en agar sangre, agar chocolate y agar CLDE para comprobar la presencia de los tres microorganismos y la cantidad de colonias presentes en el mismo. Se verificó la existencia de los tres microorganismos en la concentración inicial.
Un volumen estandarizado (1 ml en incisivos y caninos y 0,5 ml en raíz distovestibular) del inóculo fue colocado en los conductos radiculares de las piezas dentarias mediante jeringa descartable de 2.5 ml y aguja descartable acodada de calibre 25x8 para incisivos y caninos y 15x0.5 para raíces distovestibulares de 1º molar superior. Las piezas dentarias inoculadas fueron llevadas a estufa de cultivo durante 72 hs. a 37º C, en caja metálica estéril.
Luego fueron instrumentadas siguiendo los principios de la preparación quirúrgica corono apical. Se utilizaron limas lisas flexibles y fresas Gates Glidden Nº 1, 2 y 3. En las raíces distales de 1º molar superior sólo se empleo la fresa Gates Glidden Nº 1. Se tomó como instrumento de memoria para incisivos y caninos una lima Nº 50 y para las raíces distovestibulares de primer molar superior una lima Nº 35.
Los grupos A, B, y C fueron subdivididos en cuatro subgrupos, denominados 1, 2, 3 y 4, de diez piezas dentarias cada uno. La solución irrigadora y la técnica de irrigación fueron diferentes en los distintos subgrupos y en todos se utilizó el mismo procedimiento de instrumentación mecánica descripto:
GRUPO A
A.1. Diez Incisivos Centrales Superiores. Durante la preparación mecánica se utilizó como irrigante solución fisiológica estéril.
A.2. Diez Incisivos Centrales Superiores. Durante la preparación mecánica se utilizó como irrigante solución fisiológica estéril con activación ultrasónica.
A.3. Diez Incisivos Centrales Superiores. La solución irrigadora fue hipoclorito de sodio al 5%.
A.4. Diez Incisivos Centrales Superiores. Durante la preparación mecánica la solución irrigadora fue hipoclorito de sodio al 5% con activación ultrasónica.
GRUPO B
B.1. Diez Caninos Superiores. Se empleó como irrigante solución fisiológica estéril.
B.2. Diez Caninos Superiores. Irrigados con solución fisiológica estéril con activación ultrasónica.
B.3. Diez Caninos Superiores. La solución irrigadora fue hipoclorito de sodio al 5%.
B.4. Diez Caninos Superiores. Usando como solución irrigadora hipoclorito de sodio al 5% con activación ultrasónica.
GRUPO C
C.1. Diez Raíces Distales de Primer Molar Superior. Irrigadas con solución fisiológica estéril
C.2. Diez Raíces Distales de Primer Molar Superior. Irrigadas con solución fisiológica estéril y activación ultrasónica.
C.3. Diez Raíces Distales de Primer Molar Superior. Irrigadas con solución de hipoclorito de sodio al 5%.
C.4. Diez Raíces Distales de Primer Molar Superior. Irrigadas con solución de hipoclorito de sodio al 5% con activación ultrasónica.
Las soluciones irrigadoras fueron llevadas al sistema de conductos radiculares con jeringa descartable de 2.5 ml y aguja descartable acodada y sin bisel de calibre 25x8 para incisivos y caninos y 15x0.5 para raíces disto vestibulares de 1º molar superior.
Se utilizó 1 ml de solución irrigadora luego de cada dos instrumentos. La activación ultrasónica se hizo con una lima Nº 20 instalada en un sistema Cavi Endo modificado (sin el sistema de irrigación), durante 15 segundos.
Luego del tratamiento, y siguiendo con una técnica aséptica, se retiraron los topes apicales de acrílico con un extractor de coronas, y las piezas dentarias fueron seccionadas con un golpe de cincel de Black estéril sobre gasa esterilizada, llevando la mitad que poseía la sección de conducto radicular más profunda a un tubo cerrado con tapón bacteriológico, conteniendo solución fisiológica estéril, homogeneizado y repicado en agar sangre para identificar y cuantificar la flora obtenida con la del inóculo.
Se cuantificaron las colonias supervivientes de los tres microorganismos del inóculo, registrándose en planillas diseñadas ad hoc.
De las otras mitades radiculares, fue elegida al azar una muestra de cada uno de los subgrupos, la que, previa fijación en una solución de glutaraldehido al 20 % con Buffer Sorensen de pH 7, fue analizada con microscopía electrónica de barrido para evaluar la limpieza de los conductos.
Las muestras fueron secadas por punto crítico en un aparato Polaron (Inglaterra), y luego llevadas a una metalizadora en plasma de argón marca Pelco modelo Sputter Coater 91000, para observarlas en un Microscopio Electrónico de Barrido marca Jeol 35 CF, con sistema de digitalización de imágenes EDAX, operándolo a 5 kV para minimizar el efecto de carga.
RESULTADOS
Al realizar el recuento de colonias supervivientes al tratamiento realizado pudo observarse que: (TABLA I)
En los grupos en los que se utilizó hipoclorito de sodio, con o sin activación ultrasónica, la desinfección fue más efectiva en los incisivos centrales superiores.
Entre los caninos superiores hubo una pieza dentaria en la que se encontraron colonias supervivientes al utilizar hipoclorito de sodio, mientras que cuando el hipoclorito de sodio fue activado ultrasónicamente se encontraron colonias sobrevivientes en dos piezas, aunque debe destacarse que la cantidad de colonias aisladas fue menor que cuando no se utilizó el ultrasonido.
En la muestra de las raíces disto vestibulares de los primeros molares superiores se aislaron colonias luego del tratamiento utilizando como solución irrigadora el hipoclorito de sodio, en tanto que también fue posible aislarlas en una pieza dentaria al utilizar hipoclorito de sodio con activación ultrasónica.
Con la solución fisiológica estéril como sustancia de irrigación hubo desarrollo bacteriano en la totalidad de las piezas dentarias de todos los grupos de la muestra, tanto con como sin activación ultrasónica, a excepción de una del grupo B.1 (caninos superiores) en la que hubo, además, desarrollo de bacilos característicos contaminantes del medio, presumiblemente debido a un error de técnica.
En todos los casos la cantidad de colonias fue menor que las del inóculo. Puede graficarse una comparación de los distintos grupos dentarios con cada uno de los tratamientos, apareciendo los caninos superiores como la pieza dentaria peor desinfectada por encima de las raíces disto vestibulares de los primeros molares superiores y de los incisivos centrales superiores.
TABLA I (los números representan colonias sobrevivientes.)
|
|
A.1 |
B.1 |
C.1 |
A.2 |
B.2 |
C.2 |
A.3 |
B.3 |
C.3 |
A.4 |
B.4 |
C.4 |
* |
|
|
49 |
60 |
75 |
17 |
50 |
25 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
S. |
40 |
82 |
26 |
27 |
47 |
19 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
|
27 |
70 |
33 |
16 |
31 |
30 |
0 |
0 |
0 |
0 |
8 |
0 |
|
|
a |
43 |
37 |
49 |
9 |
54 |
41 |
0 |
0 |
0 |
0 |
0 |
2 |
|
|
u |
0 |
59 |
48 |
15 |
61 |
29 |
0 |
0 |
10 |
0 |
0 |
0 |
|
|
r |
24 |
40 |
29 |
21 |
59 |
45 |
0 |
18 |
0 |
0 |
0 |
0 |
|
|
e |
20 |
26 |
44 |
0 |
36 |
21 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
u |
20 |
49 |
35 |
5 |
52 |
19 |
0 |
0 |
11 |
0 |
0 |
0 |
|
|
s |
50 |
+ |
29 |
2 |
37 |
31 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
|
45 |
60 |
37 |
0 |
20 |
35 |
0 |
0 |
0 |
0 |
2 |
0 |
|
|
|
51 |
48 |
65 |
21 |
52 |
23 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
|
54 |
70 |
28 |
30 |
45 |
21 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
E. |
25 |
60 |
37 |
19 |
40 |
32 |
0 |
0 |
0 |
0 |
6 |
0 |
|
|
|
33 |
45 |
38 |
10 |
60 |
37 |
0 |
0 |
0 |
0 |
0 |
5 |
|
|
c |
22 |
82 |
40 |
17 |
65 |
27 |
0 |
0 |
7 |
0 |
0 |
0 |
|
|
o |
35 |
38 |
28 |
23 |
48 |
51 |
0 |
21 |
0 |
0 |
0 |
0 |
|
|
l |
19 |
29 |
41 |
20 |
40 |
20 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
i |
17 |
52 |
40 |
9 |
55 |
17 |
0 |
0 |
17 |
0 |
0 |
0 |
|
|
|
48 |
+ |
32 |
8 |
39 |
33 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
|
47 |
55 |
38 |
4 |
31 |
36 |
0 |
0 |
0 |
0 |
5 |
0 |
|
|
S. |
30 |
68 |
63 |
20 |
50 |
27 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
|
39 |
67 |
24 |
32 |
49 |
25 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
v |
26 |
82 |
38 |
16 |
33 |
27 |
0 |
0 |
0 |
0 |
10 |
0 |
|
|
i |
32 |
54 |
42 |
0 |
53 |
33 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
r |
17 |
71 |
37 |
12 |
69 |
21 |
0 |
0 |
15 |
0 |
0 |
0 |
|
|
i |
43 |
32 |
34 |
20 |
52 |
50 |
0 |
25 |
0 |
0 |
0 |
0 |
|
|
d |
25 |
24 |
46 |
15 |
39 |
22 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
a |
0 |
40 |
39 |
11 |
49 |
20 |
0 |
0 |
13 |
0 |
0 |
0 |
|
|
n |
47 |
+ |
26 |
5 |
41 |
35 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
s |
36 |
50 |
34 |
2 |
28 |
30 |
0 |
0 |
0 |
0 |
0 |
0 |
|
|
|
30 |
27 |
30 |
30 |
30 |
30 |
30 |
30 |
30 |
30 |
30 |
30 |
TOTAL |
|
|
32.13 |
53.70 |
39.16 |
13.53 |
44.60 |
29.40 |
0 |
2.13 |
2.43 |
0 |
1.03 |
0.23 |
PROMEDIO |
|
|
14.38 |
17.03 |
11.73 |
8.97 |
12.17 |
9.06 |
0 |
6.57 |
5.17 |
0 |
2.61 |
0.97 |
DESV.EST. |
* SubGrupos: A- Incisivos Centrales Superiores, B- Caninos Superiores, C-Raíz distal de Primer Molar Superior; + Contaminado
ANALISIS ESTADISTICO
Se utilizó para el análisis el test chi cuadrado con un nivel de significación del 1 % (p=0,01)
Irrigación con Solución Fisiológica Estéril.
De acuerdo a la similitud de valores observados para cada uno de los microrganismos y a la aplicación del test la proporción de contaminados con las tres bacterias (Staphylococcus aureus, Escherichia coli y Streptococcus viridans) puede decirse que es la misma, por lo que pueden analizarse como un todo.
Las pruebas de comparación de proporciones de contaminados entre Incisivos y Caninos, Incisivos y Raíces Distales de los Primeros Molares fueron estadísticamente significativas (p=0,01), de lo que se desprende que el porcentaje mayor de contaminados lo podemos asignar a los Caninos, luego a la Raíces Distales de los Primeros Molares, y por último a los Incisivos.
Irrigación con Solución Fisiológica Estéril activada ultrasónicamente.
Para los Incisivos el test chi cuadrado nos conduce a rechazar la igualdad de proporciones de desinfectados al analizar cada una de las tres bacterias, por lo que deben construirse porcentajes de infectados para cada una de las bacterias, con un intervalo de confianza del 95 %.
Al analizar los resultados de los Caninos y las Raíces Distales de los Primeros Molares Superiores puede considerarse el mismo porcentaje de desinfectados para las tres bacterias del inóculo al realizar el test de chi cuadrado.
El test chi cuadrado para la proporción de desinfectados con las tres bacterias para Caninos y Raíces Distales de los Primeros Molares es estadísticamente significativo (p=0,01) lo que nos conduce a decir que la proporción de contaminados en Caninos es mayor que en Raíces Distales de los Primeros Molares, similar deducción puede inferirse de la comparación de los Caninos con cada una de las tres bacterias analizadas en los Incisivos Centrales.
Comparación de los Sub Grupos irrigados con solución fisológica
Al realizar pruebas de homogeneidad de proporciones para comparar los resultados de los Sub Grupos A.1, B.1, C.1 y A.2, B.2, C.2 (piezas dentarias irrigadas con solución fisiológica estéril sin y con activación ultrasónica) considerando las tres bacterias del inóculo muestran resultados estadísticamente significativos (p=0,01), siendo mayores las proporciones de sobrevida bacteriana en los Sub Grupos A.1, B.1 y C.1 (Solución Fisiológica Estéril) que en los Sub Grupos A.2, B.2 y C.2 (Solución Fisiológica Estéril + ultrasonido).
Solución irrigadora Hipoclorito de Sodio
En los grupos irrigados con hipoclorito de sodio con o sin activación ultrasónica, dada la baja cantidad de colonias supervivientes para poder realizar un análisis estadístico, debe evaluarse el grado de desinfección obtenido con el tratamiento para una proporción de desinfección del 99 %.
De la comparación de los porcentajes de desinfección surge que los valores de desinfección son menores para el Canino Superior (B.3) y la Raíz Disto Vestibular del Primer Molar Superior (C.3) que para el Incisivo Superior (A.3)
Solución irrigadora Hipoclorito de Sodio + ultrasonido
El test aplicado no da resultados estadísticamente significativos (p=0,01), entre las piezas dentarias de diferente anatomía, para una proporción de desinfección superior al 99%.
Comparación de los Sub Grupos irrigados con hipoclorito de sodio
Al comparar los resultados de los Sub Grupos A.3, B.3, C.3 y A.4, B.4, C.4 (piezas dentarias irrigadas con hipoclorito de sodio sin y con activación ultrasónica), puede decirse que los Sub Grupos A.3, B.3 y C.3 (Hipoclorito de Sodio) presentaron un porcentaje de desinfección menor que los Sub Grupos A.4, B.4 y C.4 (Hipoclorito de Sodio + ultrasonido).
El análisis del estudio con Microscopía Electrónica de Barrido (M.E.B.) de los diferentes grupos de este estudio, sólo puede hacerse en forma cualitativa, ya que no puede estandarizarse un método que pueda repetirse para lograr imágenes de la misma zona en todas las piezas dentarias, debido a la variabilidad de tamaño y forma de las piezas dentarias que componen la muestra y a lo sensible que es la técnica de la microscopía electrónica. Además no puede cuantificarse la cantidad de microrganismos debido a que durante la fijación de las muestras y la manipulación necesaria para la preparación de las mismas (punto crítico, metalización) puede haber modificaciones en las mismas.
En todas las muestras, una de cada uno de los sub grupos, se observó la compactación de barro dentinario en las paredes del conducto radicular, en mayor o menor medida
En el tercio medio de la raíz disto vestibular del primer
molar superior se pudo apreciar la huella dejada por la fresa Gates Glidden en
el barro dentinario compactado. (FIGURA I)

Figura I
Comparativamente, el barro dentinario observado en los tercios coronarios de todas las piezas dentarias irrigadas con hipoclorito de sodio y activación ultrasónica aparenta ser de menor espesor que en el resto de las muestras. (FIGURA II)
En el tercio apical de todas las piezas dentarias irrigadas con solución fisiológica estéril, con o sin el uso de ultrasonido, se observó la presencia de microrganismos. (FIGURAS III, IV)

Figura II

Figura III
En el tercio medio del canino superior irrigado con solución fisiológica y agitación ultrasónica se pudo observar una zona del conducto en la cual existían restos pulpares y fibras no calcificadas de predentina con microrganismos alrededor de los túbulos dentinarios, lo que permite pensar que esta zona no fue alcanzada por la preparación realizada. La observación fue, probablemente, posible debido a la acción de las ondas ultrasónicas que permitieron el desprendimiento del barro dentinario a ese nivel. (FIGURA V)

Figura IV
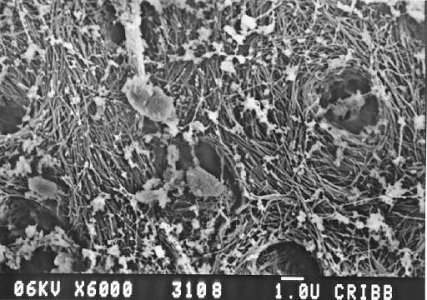
Figura V
De las piezas dentarias
irrigadas con hipoclorito de sodio, la raíz disto vestibular del primer molar
superior y el incisivo central superior aparentan ser las que presentan mayor compactación de barro dentinario
en el tercio coronario; probablemente debido a que el canino superior tiene un
diámetro mayor en el tercio coronario que el resto de las piezas dentarias
evaluadas lo que hace que la fresa
Gates Glidden no contacte a ese nivel con todas las paredes del conducto
radicular. (FIGURA VI)

Figura VI
DISCUSION
La limpieza de los conductos radiculares es un aspecto de la instrumentación difícil de cuantificar. El éxito de la obturación es atribuido a un adecuado, no absoluto, debridamiento.(16)
Al analizar los resultados surge que el hipoclorito de sodio es una excelente solución irrigadora para el tratamiento endodóntico, lo cual es una evidencia compartida por la totalidad de los autores que lo evaluaron de diferentes formas.(17,18-23,24)
Considerando los resultados hallados en los diferentes grupos de estudio (según anatomía topográfica), puede decirse que los caninos superiores son, dentro de las piezas dentarias evaluadas, los que presentaron mayor dificultad para su desinfección con las técnicas propuestas.
Esto se debe a la complejidad de la cavidad pulpar que presentan estas piezas dentarias, descriptas por autores como Pucci y Pagano,(25,26) y que se evidenciaron en las secciones longitudinales de las raíces utilizadas en este estudio.
Esto coincide con lo descripto por Gani, quien dice que "el canino superior presenta con mucha frecuencia en el tercio medio mayor amplitud que en el tercio coronario" y recomienda que la cavidad de apertura debe tener una mayor extensión en sentido vestíbulo palatino. (27)
Pese a una superficie radicular externa aparentemente simple, el interior del conducto radicular puede presentar los hallazgos descriptos que dificultan el acceso del instrumental. Esto concuerda con lo descripto por Gani y Visvisian en un estudio realizado sobre el primer molar superior, quienes dicen que a pesar de la indudable correlación de la forma del conducto con la forma de la raíz, esta asociación no siempre es vista en todos los casos clínicos. (28)
Se observó, mediante Microscopía Electrónica de Barrido, en el tercio medio del conducto remanentes pulpares y fibras no calcificadas de predentina con microorganismos circundando los túbulos dentinarios al utilizar solución fisiológica como irrigante.
Este hallazgo puede ser consecuencia de las irregularidades topográficas del canino superior que presenta un conducto, al corte transversal, con un eje mayor vestíbulo palatino; esto coincide con lo descripto por Ulfohn y colaboradores quienes concluyen que la preparación quirúrgica en conductos aplanados deja amplias zonas del conducto sin instrumentar al evaluar la presencia de barro dentinario en molares superiores e inferiores. (29)
La raíz distovestibular del primer molar superior no presentó grandes dificultades en su desinfección; el índice de curvatura de la raíz, porcentualmente poco frecuente, puede representar un obstáculo.
En coincidencia con Mc Comb y colaboradores,(30) y Baumgartner y colaboradores (31) hemos encontrado, mediante microscopía electrónica de barrido, compactación de barro dentinario en mayor o menor grado en las paredes de los conductos.
Además pudimos observar que con la técnica corono apical se produjo una mayor compactación de detritus en el tercio coronario del conducto favorecida, probablemente, por el avance del instrumento, hallazgos que coinciden con los de Heard y Walton (32) cuando compararon diferentes técnicas de preparación quirúrgica.
Algunos estudios sugieren que el uso del ultrasonido en endodoncia contribuye a la remoción del barro dentinario en forma más efectiva,(33-36) mientras otros encuentran que el ultrasonido tiene un mínimo efecto en este sentido. (37-39)
Al realizar un análisis cualitativo de las imágenes obtenidas por Microscopía Electrónica de Barrido podríamos inferir que, al activar ultrasónicamente la solución irrigadora, el barro dentinario de la superficie de los conductos tendría un espesor menor que cuando no se utiliza el ultrasonido; datos que se aproximan a los hallazgos de Ciucchi y colaboradores (38) quienes describen que solamente el 27 % de las superficies observadas en su estudio se encuentran libres de barro dentinario en el tercio medio radicular. En el mismo sentido, Barbakow y colaboradores encontraron cantidades de barro dentinario significativamente menores en los especimenes tratados con ultrasonido.(40)
Este aparente cambio en el barro dentinario podría deberse, en los grupos en los que se utilizó hipoclorito de sodio como solución irrigadora, a la disminución del contenido orgánico del mismo (que se cree que está compuesto por partículas de tejidos calcificados con material orgánico tal como tejido pulpar, bacterias y subproductos sanguíneos),(41) probablemente debido a que la activación ultrasónica permite la llegada de la solución irrigadora a áreas no instrumentadas y contribuye a un mejor debridamiento de conductos constrictos o complejos, de acuerdo a Baumgartner y colaboradores. (31)
En nuestro estudio observamos que la activación ultrasónica del hipoclorito de sodio al 5 % mejora los porcentajes de desinfección de modo que, aunque hay microorganismos vivos, no hay diferencias estadísticamente significativas (p=0,01) entre las diferentes anatomías topográficas estudiadas.
La menor sobrevida bacteriana comprobada cuando utilizamos la activación ultrasónica de la solución fisiológica estéril, puede ser resultado de su acción destructiva sobre la membrana celular de los microorganismos.(42)
Debe considerarse, como lo proponen Jensen y colaboradores, (43) que una variable difícil de controlar en estudios de la acción ultrasónica de este tipo, es el tamaño del conducto que puede influenciar la incidencia de la acción del instrumento ultrasónico y la eficacia del mismo en el debridamiento. Aunque se intente un criterio de selección designado para obtener conductos de similar morfología, hay una considerable variación en el tamaño final de cada conducto.
CONCLUSIONES
La metodología propuesta ha demostrado su utilidad para la evaluación del grado de desinfección del sistema de conductos radiculares, pero es engorroso sobre todo en el manejo de raíces de tamaño pequeño, como la distal del primer molar superior, y requiere entrenamiento previo del operador.
La microscopía electrónica de barrido es útil para una evaluación cualitativa de la limpieza, aunque ésta no pueda correlacionarse con la desinfección, debido a que la presencia de barro dentinario no removido puede ocultar microorganismos subyacentes interpuestos entre éste y la pared del conducto.
El hipoclorito de sodio al 5 % demostró ser, pese a su relativa efectividad, una excelente solución irrigadora para la desinfección del sistema de conductos radiculares. Por lo tanto, su empleo como irrigación bactericida es recomendable como complemento indispensable de la preparación mecánica de los conductos radiculares infectados, más aún cuando se lo compara con la solución fisiológica estéril.
En nuestro estudio se observó que la activación ultrasónica del hipoclorito de sodio aumenta su acción antiséptica, posiblemente porque permite una mayor penetración en las intrincadas anfractuosidades de la anatomía topográfica. Igualmente, al activar ultrasónicamente la solución fisiológica estéril, la sobrevida bacteriana fue menor. Por esto, debe considerarse al ultrasonido un valioso coadyuvante para la desinfección endodóntica.
Merece atención especial la presencia de barro dentinario, debido a que si no es eliminado totalmente, será necesario neutralizarlo para disminuir la posibilidad reinfectante de microorganismos que queden atrapados en su interior, o entre él y las paredes del conducto, donde podrían encontrar substratos suficientes para su sobrevida.
La eficacia de la desinfección en la terapia endodóntica está íntimamente relacionada con la anatomía topográfica, debido a que a mayor complejidad anatómica, mayor dificultad para la llegada de los instrumentos y de las soluciones irrigadoras a la totalidad de las paredes y accidentes topográficos del conducto radicular.
El conocimiento minucioso de la anatomía endodóntica debe recrearse como punto de partida fundamental para el tratamiento de las afecciones pulpares. Es indispensable tenerla en cuenta, al elegir el instrumental y la técnica para desinfectar y conformar el sistema de conductos radiculares infectados.
La variabilidad anatómica hace que cada tratamiento deba ser planificado individualmente, e implica que no existen técnicas ni instrumental infalibles que garanticen, en todos los casos, la conformación y desinfección del sistema de conductos radiculares.
AGRADECIMIENTOS
- Al Servicio de Bacteriología del Hospital de Niños Zona Norte, Rosario, ARGENTINA.
- Al Servicio de Grandes Instrumentos del Centro Regional de Investigaciones Básicas y Aplicadas de Bahía Blanca (CRIBABB), dependiente del CONICET, ARGENTINA.
BIBLIOGRAFIA
1) Ingle J.I., Bakland L.K. Endodoncia. 4º Edición. Editorial Mc Graw Hill Interamericana, 1998:187.
2) Miller W.D. An introduction in the study of the bacteriopathology of the dental pulp. Dental Cosmos, 36:505, 1894. Citado en Endodoncia, 4º Edición, Ingle J.I., Bakland L.K. Editorial Mc Graw Hill Interamericana, 1998:638.
3) Burket LW. Recent studies relating to periapical infection, including data obtained from human cecropsy studies. J Am Dent. Assoc 1938; 25:260.
4) Grossman LI. Origin of microorganisms in traumatized pulpless sound teeth. J Dent Res 1967; 46:551.
5) Melville TH, Birch RH. Root canal and periapical floras of the infected teeth. Oral Surg 1967; 23:93.
6) Winkler KC, Van Amerongen J. Bacteriologic results form 4000 root canal cultures. Oral Surg 1959; 12:857.
7) Brown LR, Rudolph CE. Isolation and identification of microorganisms form unexposed canals of pulp involved teeth. Oral Surg 1957; 19:1094.
8) Kettering J, Torabinejad M, Jones S. Identification of bacteria involved in pathogenesis of human periapical lesions by the ELISA technique. J Endodon 1988; 14:198.
9) Keudell Kc. Microorganisms isolated from pulp chambers. J Endodon 1976; 2:146.
10) Sundqvist G, Johansson E, Sjogren U. Prevalence of black pigmented bacteroides species in root canal infections. J Endodon 1989; 15:13.
11) Wittgrow WC, Sabiston CB. Microorganisms from pulpal chambers of intact teeth with necrotic pulp. J Endodon 1975; 1:168.
12) Fish EW. Bone infection. J Amer Dent Ass 1939; 26(5):691. En Leonardo MR, Leal JM, Simoes Filho AP. Endodoncia, Tratamiento de los conductos radiculares. Editorial Médica Panamericana, 1983:37.
13) Ingle J.I., Bakland L.K. Endodoncia. 4º Edición. Editorial Mc Graw Hill Interamericana, 1998:187.
14) Tate WH, White RR. Disinfection of human teeth for educational purposes. J of Dent Educ 1991; 55:583.
15) Recommended Infection Control Practices for Dentistry. Center for Disease Control and Prevention (CDC) Atlanta Estados Unidos. MMWR May 28,1993;42 Nº RR-8.
16) Yee RDJ. The effect of canal preparation on the formation and leajage characteristics of the apical dentin plug. J Endodon 1984; 10:308.
17) Byström A., Sundqvist G. The antibacterial action of sodium hypochlorite and EDTA in 60 cases of endodontic therapy. Int End J 1985; 18:35.
18) Briseño BM, Wirth R, Hamm G, Standhartinger W. Efficacy of different irrigation methods and concentrations of root canal irrigation solutions on bacteria in the root canal. B. M. Endod Dent Traumatol 1992; 8:6.
19) Grossman LI, Meiman B. Solution of pulp tissue by chemical agents. J Am Dent Assoc 1941; 28:223.
20) Weine F. Agentes Irrigantes y Quelantes, en Terapéutica en Endodoncia. 2º Edición. Editorial Salvat, 1991:360
21) Gordon T., Damato D, Christner P. Solvent effect of various dilutions of sodium hypochlorite on vital and necrotic tissue. J Endodon 1981; 7:466.
22) Mc Comb D, Smith DC. A preliminary scanning electron microscopic study of the efficacy of various irrigating solutions. J Endodon 1975; 1:238.
23) Senia E.S., Marshall F.J., Rosen S. The solvent action of sodium hypoclorite on pulp tissue of extracted teeth. Oral Surg 1971;31:96.
24) Ingle JI, Bakland LK. Endodoncia. 4º Edición. Editorial Mc Graw Hill Interamericana, 1998; 653.
25) Pucci F.M, Reig R. Conductos Radiculares. Anatomía, patología y terapia. Volumen I Primera Parte. Editorial Médico Quirúrgica. Buenos Aires, 1944:188.
26) Pagano J. L. Anatomía Dentaria. 1º Edición. Editorial Mundi, 1965:259.
27) Gani OA. Estudio radiográfico de la obturación de conductos en dientes extraídos. Rev. Odont. Fac. Odont. U.N.C., 1968; 3, IV:131.
28) Gani OA, Visvisian C. Apical canal diameter in the first upper molar at various ages. J Endodon 1999; 25:689.
29) Ulfohn R, David OJ, Rodrigo S, Visvisian C. Presencia de lodo dentinario posterior a la preparación quirúrgica en molares. Rev Esp Endodoncia 1985; 3,III:97.
30) Mc Comb D, Smith CD. A preliminary scanning microscopy study of root canals after endodontic procedures. J Endodon 1975; 1:238.
31) Baumgartner JC, Cuenin PR. Efficacy of several concentrations of sodium hypoclorite for root canal irrigation. J Endodon 1992; 18:605.
32) Heard F, Walton RE. Scanning electron microscope study comparing four root canal preparation techniques in small curved canals. Int End J 1997; 30:323.
33) Buchanan L.S. Limpieza y conformación del sistema de conductos radiculares; en Los caminos de la pulpa. Cohen y Burns. 5º Edición. Editorial Médica Panamericana, 1993:219.
34) Fogel HM, Pashley DH. Dentin permeability: effects of endodontic procedures on root slabs. J Endodon 1990; 16:442.
35) Cameron JA. The use of ultrasonics in the removal of the smear layer: a scanning electron microscope study. J Endodon 1983; 9:289.
36) Cheung JR, Stock JR. In vitro cleaning ability of root canal irrigants with and without endosonic. Int End J 1993; 26:334.
37) Ahmad M, Pitt Ford TR, Crum LA. Acoustic cavitation and its implications an ultrasonic root canal debridement. J Endodon 1987; 13:131 (Abstract 14).
38) Ciucchi B, Khettabi M, Holtz J. The effectiveness of different endodontic irrigation procedures on the removal of the smear layer: a scanning electron microscopic study. Int Endod J 1989; 22:21.
39) Abbott PV, Heijkoop PS, Cardaci SC,Hume WR, Heithersay GS. An SEM study of the effects of different irrigation sequences and ultrasonics. Int End J 1991; 24:308.
40) Barbakow F, Peters O, Leu B. Effect of ultrasonics & NaOCl on smear layer & debris on root canal walls. J Endodon 1999; 25:297, Abstract OR 60.
41) Mader CL, Baumgartner JC, Peters DD. Scanning electron microscopic investigation of the smeared layer on root canal walls. J Endodon 1984; 10:477.
42) Walmsley AD. Ultrasound and root canal treatment: the need for scientific evaluation. Int End J 1987; 20:105.
43) Jensen SA, Walker TL, Hutter JW, Nicoll BK. Comparison of the cleaning efficacy of passive sonic activation and passive ultrasonic activation after hand instrumentatioon in molar root canals. J Endodon 1999; 25:735.