Constante de Madelung
Cuando se estudia la energética de los sólidos iónicos, se observa que la estabilidad de los mismos se debe fundamentalmente a la llamada Energía de red o Energía reticular (U), que se define como "La energía que se desprende cuando un conjuntos de iones positivos y negativos se combinan para formar un mol del compuesto iónico sólido.
La siguiente fórmula muestra los factores que influyen en el valor de la energía de red de un compuesto iónico.
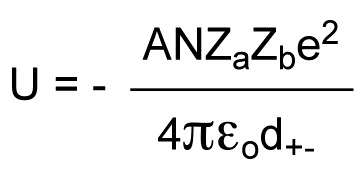
Vemos que U es directamente proporcional a la carga de los iones, catión y anión, Zae y Zbe, (e=la carga del electrón), e inversamente proporcional a la distancia interiónica, d+-. Aparece el número N, número de Avogadro. La constante A que aparece en la expresión se denomina constante de Madelung. Vamos a ilustrar cual es el significado de esta constante para el caso de la estructura de NaCl.
Si representamos la celda unidad de NaCl y elegimos como referencia el ion que se encuentra en el centro, observamos que se encuentra inmediatamente rodeado por seis aniones.
En la siguiente esfera de coordinación el ion central se encuentra rodeado por doce cationes. De nuevo en una siguiente esfera de coordinación este catión central se encuentra rodeado por ocho aniones.
Para conseguir un mejor ajuste entre en el valor calculado para la constante A y el valor teórico, hay que incluir mas términos de atracción/repulsión electrostática.
Si ampliamos la celda unidad vemos que el ion central se encuentra rodeado por seis cationes.
Si se incorporan a la fórmula de Coulomb los sucesivos términos de atracción y repulsión nos iremos aproximando al valor teórico, que es el límite de esa serie de números.