Amedeo Avogadro (1776-1856)
Más
información y bibliografía sobre el personaje en:
MUÑOZ, R. y BERTOMEU SANCHEZ, J.R. (2003) La historia de la ciencia en los libros de texto: la(s) hipótesis de Avogadro,
Enseñanza de las ciencias,
21 (1), 147-161.
También se pueden consultar los extractos de su ensayo de 1811
|
Amedeo Avogadro (1776-1856) es una de las figuras más
conocidas de la historia de la química. La hipótesis que generalmente se
asocia con su nombre le ha otorgado un lugar destacado en la memoria de la
comunidad científica y su nombre aparece en la mayoría de los manuales
elementales de física y química como uno de los autores más importantes del
siglo XIX. No obstante, si se observan con más detalle estos libros de texto,
se puede fácilmente comprobar que sus autores no están de acuerdo respecto a
la naturaleza y las consecuencias de las contribuciones de Avogadro. Algunos
libros le atribuyen la hipótesis que afirma que volúmenes idénticos de dos
gases en las mismas condiciones de presión y temperatura contienen el
mismo número de partículas. Otros
añaden a esta hipótesis una segunda acerca
de la submolecularidad de las partículas de los gases, incluyendo, en
ocasiones, la supuesta afirmación de Avogadro sobre el carácter diatómico de
las moléculas de las sustancias simples. Tanto unos como otros suelen estar
de acuerdo en la importancia de estas hipótesis para la consolidación de la
teoría atómica en el siglo XIX. También suelen coincidir los autores de
libros de texto en retratar a Avogadro como un personaje incomprendido en su
tiempo que tenía la clave para resolver uno de los problemas más importantes de
su época: el establecimiento de un sistema de pesos atómicos. Según esta
perspectiva, las contribuciones de Avogadro sólo fueron plenamente aceptadas
en el famoso congreso de Karlsruhe gracias la intervención del químico
italiano Stanislao Cannizaro. De este modo, el problema de los pesos atómicos
quedó resuelto y la teoría atómica se transformó en uno de los pilares
fundamentales de la química. |
|
|
Esta
narración, presente en un gran número de libros de texto, resulta difícil de
aceptar tras la lectura directa de las obras de Avogadro y sus
contemporáneos. También contrasta con las conclusiones que los historiadores
de la ciencia han obtenido sobre las contribuciones de Avogadro y los
problemas relacionados con los pesos atómicos. |
|
|
|
|
|
En realidad, si no se dispone de información
microscópica sobre las características del compuesto, no es posible conocer
con facilidad el número de átomos del compuesto y, como esta cuestión es
crucial para el cálculo de pesos atómicos, los valores de estos últimos no
pueden ser conocidos con certidumbre. Vamos a ilustrar el problema con el caso del agua.
Este líquido puede ser descompuesto mediante una corriente eléctrica para
producir hidrógeno y oxígeno en una proporción de una a ocho partes en peso,
respectivamente. ¿Cómo puede calcularse el peso atómico del oxígeno a partir
de estos datos? Si se acepta que el agua está formada por dos átomos de
hidrógeno y uno de oxígeno, entonces el peso atómico de este último será 16
(8*2/1). Por el contrario, si se supone la relación de átomos es 1:1, el peso
atómico del oxígeno será de 8 (8*1/1). Esta última suposición es la que
realizó Dalton (1808) basándose en unas "reglas de máxima
simplicidad" que expresó del siguiente modo: 1ª.- Cuando sólo una combinación entre dos cuerpos
puede ser obtenida, debe suponerse que es una combinación binaria, a menos
que alguna razón indique lo contrario. 2ª.- Cuando se conocen dos combinaciones, debe
suponerse que una es binaria y otra ternaria. 3ª.- Cuando se obtienen tres combinaciones, podemos
esperar que una es binaria y las otras dos ternarias. 4ª.- Cuando se conocen cuatro combinaciones,
debemos esperar que una es binaria, otra ternaria, y otra cuaternaria, etc.
[...] Siguiendo estas reglas, Dalton concluía que
"el agua es un compuesto binario de hidrógeno y de oxígeno" (dado
que no se conocía ningún otro compuesto de estos dos elementos) y "que
los pesos relativos de estos dos átomos elementales son aproximadamente como
1:7". Del mismo modo, Dalton consideraba al amoníaco como "un
compuesto binario de hidrógeno y nitrógeno", por lo que "los pesos relativos de los dos
átomos" eran "aproximadamente como 1:5". En el caso de los óxidos del carbono,
Dalton distinguía entre una combinación binaria (el monóxido) y una combinación
ternaria (el dióxido) siguiendo la segunda de sus reglas. También aplicaba el
resto de las reglas al cálculo de las composiciones de los óxidos del
nitrógeno.
Como puede fácilmente comprobarse, los valores empleados por Dalton para la
composición del agua y el amoníaco no coinciden con los obtenidos en los
análisis químicos más modernos. Tal y como fue ampliamente reconocido por muchos
químicos de esos años, estas reglas no tenían ninguna base empírica aunque
eran necesarias para poder realizar el cálculo de pesos atómicos. Por
ejemplo, tras describir las reglas de Dalton, el famoso químico francés
Jacques Thenard (1777-1857) señalaba en su popular Tratado elemental de
química (1824) que "esta manera de determinar el número de átomos"
era "absolutamente hipotética". Según Thenard, el hecho de que dos
elementos se combinaran en una sola proporción no era razón suficiente para
concluir que tal combinación se daba átomo a átomo, como sugería la primera
de las reglas de Dalton. Quizás podría existir un compuesto desconocido de
esos elementos que invalidara la aplicación de la primera regla. Incluso en
el caso de que verdaderamente sólo existiese un compuesto de dos elementos,
"¿no podría ocurrir que esta combinación se diera entre un átomo de uno
y dos o tres átomos del otro?" – se preguntaba Thenard (1824). Nada
aparentemente permitía descartar este último modo de combinación frente a las
reglas sugeridas por Dalton. En 1824, Thenard afirmaba que, para superar
estos problemas, los químicos habían aportado "modificaciones a los
puntos de vista del sabio inglés". Estas modificaciones sólo habían
conducido a "sustituir unas hipótesis por otras" pero reconocía que
estas hipótesis resultaban "bastante probables" en el caso de
compuestos formados por elementos gaseosos. En este caso -señalaba Thenard-
los químicos admitían que "todos los gases, en el mismo volumen,
contienen el mismo número de átomos", lo que permitía simplificar el
cálculo de ciertos pesos atómicos. Indudablemente, Thenard se estaba refiriendo,
aunque sin citar su nombre, a las
propuestas que Amedeo Avogadro y Ampère realizaron entre 1811 y 1814, pocos
años después de la publicación de los trabajos de Dalton. |
|
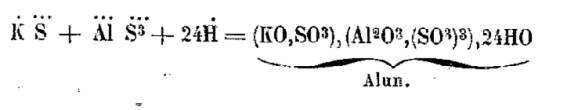
|
El
ensayo de Amedeo Avogadro (1811) Al contrario de lo que ocurría con las reglas de
Dalton, las propuestas de Avogadro estaban parcialmente basadas en las
recientes investigaciones de Gay-Lussac (1809) sobre los volúmenes de
combinación de los gases. Tras comparar los resultados de varias reacciones
químicas conocidas en las que participaban gases, Gay-Lussac había concluido
que "los gases ... en cualquiera que
sea las proporciones en las que se pueden combinar, dan siempre lugar a
compuesto cuyos elementos, medidos en volumen, son siempre múltiplos uno de
otro". En los casos investigados por Gay-Lussac, estas proporciones
habían sido "1 a 1, 1 a 2, o 1 a 3". Amedeo Avogadro comenzaba su famoso ensayo sobre
"un modo de determinar las masas relativas de las moléculas elementales
de los cuerpos" con una mención a la anterior memoria de Gay-Lussac.
Según Avogadro, dado que Gay-Lussac había mostrado que "las
combinaciones de los gases tienen lugar siempre según relaciones muy simples
en volumen", resultaba también necesario admitir la existencia de
"relaciones muy simples entre los volúmenes de las sustancias gaseosas,
y el número de moléculas simples o compuestas que los forman". Y aquí
Avogadro realizó su conocida hipótesis: "La hipótesis que se
presenta como la primera en este sentido, y que parece además la única
admisible, es suponer que el número de moléculas integrantes en unos gases
cualesquiera es siempre la misma en un volumen igual, o es siempre
proporcional a los volúmenes. En efecto, si se supusiera que el número de
moléculas contenidas en un volumen dado fuera diferente para los diferentes
gases, sería casi imposible pensar que la ley que rige la distancia de las
moléculas pudiera dar, en todos los casos, relaciones tan simples como los
hechos que acabamos de citar nos obligan a admitir entre el volumen y el
número de moléculas" Avogadro
escribió este texto en francés y prefirió emplear la palabra "molécula" en lugar de "átomo"
para discutir sus puntos de vista. Ambas expresiones eran utilizadas a
principios del siglo XIX con un significado bastante diferente al actual. En
la anterior cita aparece la expresión "moléculas integrantes" que,
como hemos señalado, era común en las publicaciones francesas de la época. No
resulta extraña esta fuerte influencia de la química francesa en la obra del
autor italiano. En los años en los que apareció su famoso ensayo, Avogadro
residía en Turín, una ciudad que, junto con el resto del Piamonte, fue
anexionada al imperio francés durante la primera década del siglo XIX
(Morselli, 1984). Avogadro conocía las obras de los más importantes autores
franceses, como Gay-Lussac y Berthollet, y, probablemente, tuvo noticia de
las ideas de Dalton a través de la traducción francesa de un popular libro de
texto de Thomas Thomson . Partiendo de la anterior hipótesis, que citaremos
de modo abreviado en lo que sigue como IV=IP (igual volumen = igual número de
partículas), Avogadro proponía un método para "determinar fácilmente las
masas relativas de las moléculas de los cuerpos que pueden pasarse al estado
gaseoso y el número relativo de estas moléculas en las combinaciones".
Si volúmenes iguales de gases contenían igual número de partículas, la
relación entre las densidades de los gases debía ser igual a la relación
entre las masas de estas partículas[i].
Avogadro también empleaba su hipótesis para establecer el número de
"moléculas" que formaban los diferentes compuestos: "Por
otro lado, como se sabe que la relación de los volúmenes del hidrógeno al
oxígeno en la formación de agua es de 2 a 1, se deduce que el agua resulta de
la unión de cada molécula de oxígeno con dos moléculas de hidrógeno.
Igualmente, de acuerdo con las proporciones en volumen establecidas por M.
Gay-Lussac para los elementos del amoníaco, del gas óxido de nitrógeno, del
gas nitroso y del ácido nítrico, el amoníaco resultará de la unión de una
molécula de nitrógeno con tres de hidrógeno, el gas óxido de nitrógeno de una
molécula de oxígeno con dos de nitrógeno, el gas nitroso de una molécula de
nitrógeno con una de oxígeno, y el ácido nítrico de una de nitrógeno con dos
de oxígeno"[ii] Avogadro era consciente que estos resultados
estaban en contradicción con los alcanzados por Dalton a partir de sus reglas
de máxima simplicidad antes mencionadas. Para Avogadro estas reglas eran
"suposiciones arbitrarias" y, por lo tanto, debían ser reemplazadas
por sus propias conclusiones en el cálculo de pesos atómicos: "Así Dalton ha supuesto que el agua estaría
formada por la unión del hidrógeno y del oxígeno, molécula a molécula. De
aquí resultaría, de acuerdo con la relación en peso de estos dos componentes,
que la masa de la molécula del oxígeno sería respecto a la del hidrógeno como
alrededor de 7 1/2 a 1, o, de acuerdo con los cálculos de Dalton, como 6 a 1.
De acuerdo con nuestra hipótesis esta relación es doble, a saber, de 15 a 1,
como hemos visto" En efecto, suponiendo ahora que "el agua
resulta de la unión de cada molécula de oxígeno con dos moléculas de
hidrógeno", Avogadro concluía que el peso atómico del oxígeno era el
doble del supuesto por Dalton, tal y como hemos visto anteriormente. Como
reconocía Avogadro, esta conclusión no estaba tampoco exenta de problemas. Si
se aceptaba que el agua estaba formada por dos "moléculas" de
hidrógeno y una de oxígeno, el valor del peso de una molécula de agua debía
ser 17 (15 + 1*2 = 17) según los
valores aceptados por Avogadro. Pero si se seguía el método basado en las
densidades de los vapores el resultado que se obtenía era diferente. En
efecto, si se dividía los valores admitidos la densidad relativa del vapor de
agua (0,625) por la del hidrógeno (0,0732) el resultado obtenido daba un peso
para la molécula de agua de 8,537, es
decir, aproximadamente la mitad del valor obtenido por la suma de los pesos de
las "moléculas" de hidrógeno y oxígeno[iii].
¿Cómo resolver esta aparente contradicción?. En realidad, el mismo problema se daba también
cuando se trataba de hacer compatibles la anterior hipótesis IV=IP con
algunos de resultados experimentales relacionados con la combinación de estas
sustancias. Por ejemplo, tal y como Avogadro señalaba, un volumen de oxígeno
se combina con dos volúmenes de hidrógeno para producir dos volúmenes de
agua. Si se admite que cada uno de estos volúmenes corresponde a un mismo
número de partículas (o moléculas como afirmaba Avogadro), se debe también
aceptar que dos moléculas de agua resultan de la combinación de una molécula
de oxígeno con dos moléculas de hidrógeno. O, dicho de otro modo, que una
molécula de agua esta formada por media molécula de oxígeno y una de hidrógeno.
Para solucionar este problema, Avogadro introdujo una nueva suposición: "basta suponer que las moléculas
constituyentes de un gas simple cualquiera (...) no están formadas por una
sola molécula elemental, sino que resultan de un cierto número de estas
moléculas reunidas en una sola por atracción, y que cuando las moléculas de
otra sustancia deben unirse a aquéllas para formar moléculas compuestas, la
molécula integrante que debería
resultar de ellas se divide en dos o más partes o moléculas integrantes
formadas de la mitad, la cuarta
parte, etc. del número de moléculas constituyentes de la otra sustancia, que
debería combinarse con la molécula total, o, lo que es lo mismo, con un
número igual al de medias moléculas, o cuartos de moléculas, etc., de esta
segunda sustancia; de modo que, el número de moléculas integrantes del
compuesto llega a ser el doble, el cuádruple, etc. de lo que debería ser sin
esta división, y el valor necesario para satisfacer el volumen del gas que
resulta[iv]" En este confuso texto, Avogadro parece sugerir que,
cuando se forman ciertos compuestos, las moléculas resultantes se dividen
"en dos o más partes", de modo que cada una de ellas puede contener
"medias moléculas, cuartos de moléculas, etc." de los reactivos que
han dado lugar a su formación. Por ejemplo, en el caso del agua, la molécula
resultante se dividía por dos y, por lo tanto, estaba formada por una
"demimolécula" (demi-molécule) de oxígeno y una molécula de
hidrógeno. Esta conclusión era acorde con la relación de densidades antes
comentada entre el hidrógeno y el vapor de agua[v].
Las ideas de Avogadro resultan evidentes en su modo de discutir, por ejemplo,
el valor del peso de la molécula de amoníaco: "En cuanto al amoníaco, la suposición de
Dalton sobre el número relativo de moléculas en su composición, sería
totalmente incorrecta [fautive] según nuestra hipótesis; Dalton supone
nitrógeno e hidrógeno unidos molécula a molécula mientras que según hemos
visto una molécula de nitrógeno se une a tres moléculas de hidrógeno. Según
él, la molécula de amoníaco sería 5 +1 = 6; según nosotros, ella debe ser (13
+ 3) / 2 = 8, o, más exactamente, 8,119, como puede deducirse también de modo
inmediato a partir de la densidad del gas amoníaco. La división de la
molécula que Dalton no hizo entrar en su cálculo, corrige también aquí el
error que resulta de sus otras suposiciones"[vi] Dado que tres volúmenes de hidrógeno más uno de
nitrógeno producían dos volúmenes de amoníaco, Avogadro se veía obligado a
suponer que en este caso tres moléculas de hidrógeno se combinaban con una de
nitrógeno y la resultante se dividía por dos. De este modo, los valores de
las densidades coincidían con los cálculos de los pesos atómicos[vii].
Es evidente que esta argumentación dista mucho de lo que se considera la
segunda hipótesis de Avogadro en muchos libros de texto: el carácter
diátomico de las moléculas de los gases elementales. Avogadro no parece
interesado por esta cuestión que apenas menciona y, en cualquier caso, señala
que estas moléculas podrían estar formadas por "cierto número de estas
moléculas reunidas en una sola por atracción", sin dar ninguna
indicación respecto a cual podría ser ese número. Por otra parte, la supuesta
"división" de las moléculas de los compuestos "en dos o más
partes" estaba condicionada por la necesidad de hacer compatibles los
valores de sus densidades con los de los pesos de las moléculas. En realidad,
al aceptar estas divisiones podemos decir que, en cierto modo, Avogadro
estaba proponiendo unos valores para los pesos de las moléculas del agua y
del amoníaco que correspondían a la mitad de los aceptados en la actualidad.
Aunque en los casos mencionados Avogadro suponía que se producía una división
por dos de las moléculas, no descartó otras posibilidades cuando los valores
de las densidades de los gases así lo exigían. |
Más
información y bibliografía sobre el personaje en:
MUÑOZ,
R. y BERTOMEU SANCHEZ, J.R. (2003) La historia de la ciencia en los libros de
texto: la(s) hipótesis de Avogadro, Enseñanza de las ciencias,
21 (1), 147-161.
Volver a
la exposición de historia de la química
Volver a la página inicial