
John Dalton
(1766-1844)

El cálculo de pesos atómicos
"En todas las investigaciones químicas, el conocimiento de los pesos relativos de los simples que constituyen un compuesto ha sido considerado con buen juicio un tema de gran importancia. Sin embargo, por desgracia, la indagación ha terminado aquí, a pesar que, de los pesos relativos en masa, los pesos relativo de las últimas partículas o átomos de los cuerpos podría haber sido inferida, y a partir de ellos su número y peso en otros compuestos saldría a la luz, para asistir y guíar investigaciones futuras y corregir sus resultados. Ahora, un objetivo importante de este trabajo es mostrar la importancia y las ventajas de averiguar los pesos relativos de las últimas partículas, tanto de cuerpos simples como compuestos, el número de partículas simples elementales que constituye una partícula compuesta, y el número de partículas menos compuestas que entran en la formación de una partícula más compuesta.
Si existen dos cuerpos, A y B, capaces de combinarse, he aquí el orden en el cual las combinaciones podrían tener lugar, comenzando por la más simple, a saber:
|
1 átomo de A + 1 átomo de B |
= 1 átomo de C, binario |
|
1 átomo de A + 2 átomos de B |
= 1 átomo de D, ternario |
|
2 átomos de A + 1 átomo de B |
= 1 átomo de E, ternario |
|
1 átomo de A + 3 átomos de B |
= 1 átomo de F, cuaternario |
|
3 átomos de A + 1 átomo de B |
= 1 átomo de G, cuaternario, etc. |
Las siguientes reglas generales pueden ser adoptadas como guías en todas nuestras investigaciones respecto a la síntesis química:
1.- Cuando sólo una combinación entre dos cuerpos puede ser obtenida, debe suponerse que es una combinación binaria, a menos que alguna razón indique lo contrario.
2.- Cuando se conocen dos combinaciones, debe suponerse que una es binaria y otra ternaria.
3.- Cuando se obtienen tres combinaciones, podemos esperar que una es binaria y las otras dos ternarias.
4.- Cuando se conocen cuatro combinaciones, debemos esperar que una es binaria, otra ternaria, y otra cuaternaria, etc.
5.- Un compuesto binario debe ser siempre explícitamente más pesado que la simple mezcla de sus dos componentes.
6.- Un compuesto ternario debe ser explícitamente más pesado que la mezcla de uno binario y uno simple que, al combinarse, lo constituyen, etc.
7.- Las anteriores reglas se aplican igualmente cuando dos cuerpos como C y D, D y E, etc., se combinan.
De la aplicación de estas reglas a hechos químicos ya bien establecidos, podemos obtener las siguientes conclusiones:
1.- Que el agua es un compuesto binario de hidrógeno y de oxígeno, y que los pesos relativos de estos dos átomos elementales son aproximadamente como 1:7
2.- Que el amoníaco es un compuesto binario de hidrógeno y ázoe, y que los pesos relativos de los dos átomos son aproximadamente como 1:5
3.- Que el gas nitroso es un compuesto binario de ázoe y de oxígeno, cuyos átomos pesan respectivamente 5 y 7; que el ácido nítrico es un compuesto binario o ternario, según su fabricación, y que consiste en un átomo de ázoe y dos de oxígeno, que pesan conjuntamente 19; que el óxido nitroso es un compuesto similar al ácido nítrico, y que está formado de un átomo de oxígeno y de dos de ázoe, pesando en total 17; que el ácido nitroso es un compuesto binario de ácido nítrico y de gas nitroso, pesando 31; que el ácido oxinítrico es un compuesto binario de ácido nítrico y de oxígeno, pesando 26;
4.- Que el óxido carbónico es un compuesto binario, formado de un átomo de carbón y un átomo de oxígeno, que pesan en conjunto 12; que el ácido carbónico es un compuesto ternario (aunque a veces binario) formado de un átomo de carbón, y de dos de oxígeno, que pesan en total 19; etc. En todos los casos, los pesos han sido expresados en átomos de hidrógeno, cada uno de ellos denotado por la unidad.
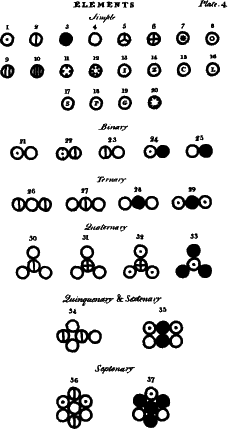
Tabla con los símbolos de los átomos
1.- Hidrógeno, su peso relativo 1
2.- Nitrógeno, 5
3.- Carbono, 5
4.- Oxígeno, 7
5.- Fósforo, 9
6.- Azufre, 13
7.- Magnesia, 20
8.- Cal, 23
9.- Soda, 28
10.- Potasa, 42
[...]
J. DALTON, A New System of Chemical Philosophy, London, 1808. vol. I, par I, Chap III, p. 211-216.
Pueden consultarse reproducciones parciales de este texto en I. Freund, The Study of Chemical Composition. An Account of its Method and Historical Development, New York, Dover, 1968 (reimpresión de la edición de Cambridge, University Press, 1904). y B. BENSAUDE-VINCENT; C. KOUNELIS, Les atomos. Une anthologie historique, Paris, Agora, 1991. (en francés). Una edición electrónica del original inglés se puede encontrar en la página de clásicos de historia de la química dirigida por Carmen Giunta. También se pueden consultar en la red datos biográficos de John Dalton