Melanoma
Dirk Schadendorf, Alexander C J van Akkooi, Carola Berking, Klaus G Griewank,
Ralf Gutzmer, Axel Hauschild, Andreas Stang, Alexander Roesch, Selma Ugurel
www.thelancet.com Vol 392 September 15, 2018
Haz clic en una imagen para ampliarla.
La transformación maligna de los melanocitos hacia melanoma
hasta llegar a dar lugar a un melanoma metastásico es el resultado de un proceso
que requiere una compleja interacción entre desencadenantes exógenos y
endógenos, así como intrínsecos al tumor y factores relacionados con el sistema
inmune. Los melanocitos tiene un bajo índice de proliferación (se dividen menos
de dos veces al año), El índice proliferativo aumenta a medida de la evolución
de las neoplasias melanocíticas acompañándose de un aumento de mutaciones
puntuales y alteraciones en el número de copias.
Los melanomas tienen una carga mutacional alta, (> 10
mutaciones por megabase) y albergan un alto número de mutaciones de firma
ultravioleta, como transiciones C → T (causada por ultravioleta B) o G→ T
(causado por ultravioleta A). Se supone que las mutaciones en el melanoma se
originan en un efecto mutagénico directo de ultravioleta B y ultravioleta A.
De manera similar a otros cánceres, la transformación
maligna en el melanoma sigue un modelo genético secuencial queda lugar a la
activación constitutiva de la señal de transducción oncogénica.
En los nevus melanocitos se puede encontrar una mutación en
el gen BRAFv600. Las presencias de mutaciones adicionales darán lugar a el
desarrollo de melanoma in situ (por ejemplo las mutaciones en TERT (promotor de
la transcriptasa inversa de la telomerasa)). Las adiciones de mutaciones
terciarias en genes involucrados en el control del ciclo celular facilitan el
potencial invasivo del melanoma (inhibidor de quinasa dependiente de ciclina 2A
[CDKN2A]), o de la remodelación de la cromatina (dominio de interacción rico en
AT [ARID] 1A, ARID1B, ARID2). La aparición de mutaciones del homólogo de
fosfatasa y tensina (PTEN) o dela proteína tumoral PT53, se asocian con la
progresión hacia melanoma metastásico.
A nivel proteico estas alteraciones genéticas producen una
estimulación recíproca de las vías celulares afectas, especialmente la vía MAPK
(proteín cinasa activada por mitógenos), PI3K (fosfoinositido3-quinasa), AKT (proteín
quinasa B, PTEn y la vía mTOR (vía diana de la rapamicina de mamífero).
El melanoma también dispone de mecanismos por los que evade
el sistema inmune. Tras el reconocimiento del antígeno tumoral por las células
T, se liberan linterferon que desencadenan la expresión mediada por JAK-STAT de
ligandos PD-1 PD-L1 y PD-L2 en la superficie de células de melanoma. La unión de
PD-L1 y PD-L2 a PD-1 conduce a la supresión de la actividad efectora de las
células T e inhibe la respuesta inmunitaria antitumoral.
|

Señalización de MAPK, PI3K-AKT y regulación del
ciclo celular en condiciones normales
permite un control equilibrado de las funciones básicas de la
célula. |
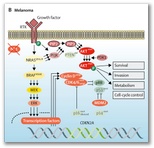
) En melanomas,Las alteraciones genética
conducen a la activación de la vía constitutiva con pérdida de
homeostasis. |
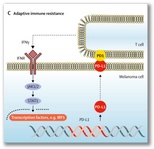
El punto de control inmune PD-1-PD-L1 está
regulado principalmente por
señalización de interferón-γ. |
|
AKT = proteína quinasa B. BRAFV600E =
protooncogén B-Raf serina / treonina quinasa (Val600Glu). CDK =
quinasa dependiente de ciclina. ERK = quinasa regulada por señales
extracelulares. IFNR = receptor de interferón. IFNγ = interferón γ.
MAPK = proteína quinasa activada por mitógenos. MDM2 = ratón
homólogo doble-minuto-2. MEK = proteína quinasa quinasa activada por
mitógenos. NF1 = neurofibromina 1. NRAS = protooncogén GTPasa de
NRAS. P = fosforilado. PD-1 = proteína de muerte celular programada
1. PDK1 = dependiente de fosfoinosítido proteína quinasa. PD-L1 =
ligando 1 de muerte celular programada. PIP = fosfatidilinositol
fosfato. PI3K = fosfoinositido-3 quinasa. pRB = proteína de
retinoblastoma. PTEN = homólogo de fosfato y tensina. RTK = receptor
de tirosina quinasa.
STAT1 = transductor de señal y activador de la transcripción 1 |


