El carbono y sus isótopos
El carbono y sus isótopos
El carbono
El carbono
es el elemento de símbolo C y número atómico Z=6.
Esto significa que un átomo de carbono tiene 6
protones en su núcleo y, para neutralizar dicha carga, 6 electrones en su capa
electrónica, con una estructura 1s22s22p2.
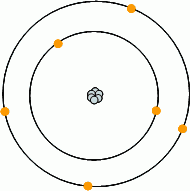
Además de estos protones y electrones, los núcleos de los átomos de carbono contienen neutrones. El número de éstos da lugar a los distintos isótopos del carbono.
Los isótopos estables del carbono
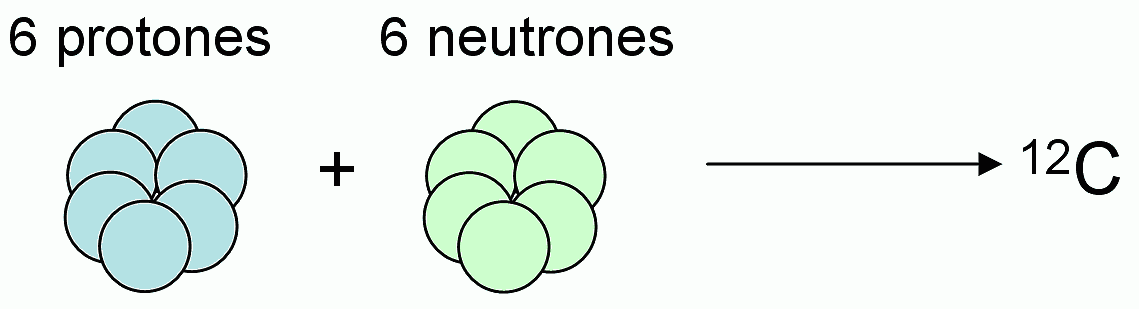
Es el isótopo de carbono más abundante (98.93 %), y sobre el cual se define el mol (el mol es la cantidad de sustancia de un sistema que contiene tantas entidades elementales como átomos hay en 0,012 kilogramos de carbono 12).
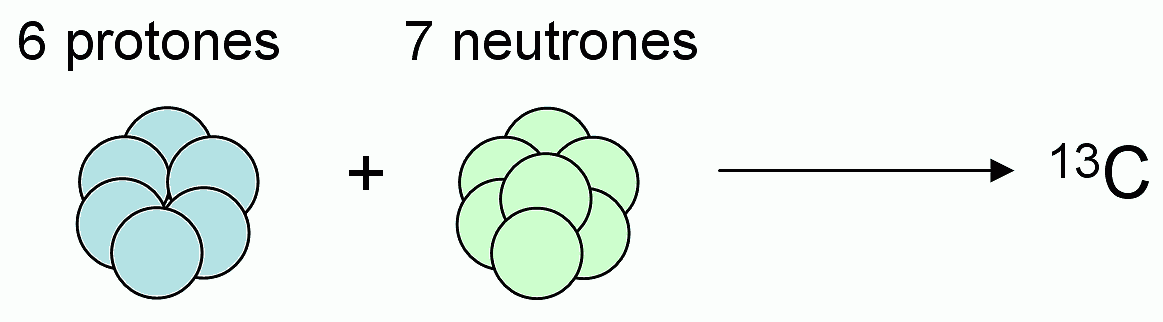
Aunque el 13C es un isótopo de carbono menos abundante que el 12C (1.07 %), también es estable físicamente.
Los isótopos inestables del carbono
10n + 147N → 146C + 11H
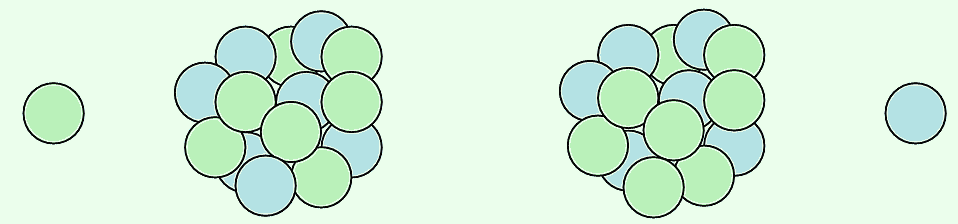
Aunque sólo existe a nivel de trazas (1 ppt del total del carbono) y es inestable, tiene una semivida bastante elevada (5730 años), descomponiéndose mediante una desintegración β- a 14N, por conversión de un neutrón a protón, y emisión de un electrón y un antineutrino electrónico (partícula sin carga, y prácticamente sin masa, con la que el sistema conserva el momento angular):
146C → 147N + 0-1e +  e
e
 e
e
Rellena los huecos:
El isótopo 11C tiene neutrones en su núcleo.
El isótopo C tiene 9 neutrones en su núcleo.