Cellular response to external signals in Saccharomyces cerevisiae
- Authors: Doctoranda: Tianlu Li (Beca predoctoral Grisolía, Generalitat Valenciana). Directora: Paula Alepuz Martínez. (2015).
- Publication types: Tesi
-
Abstract:
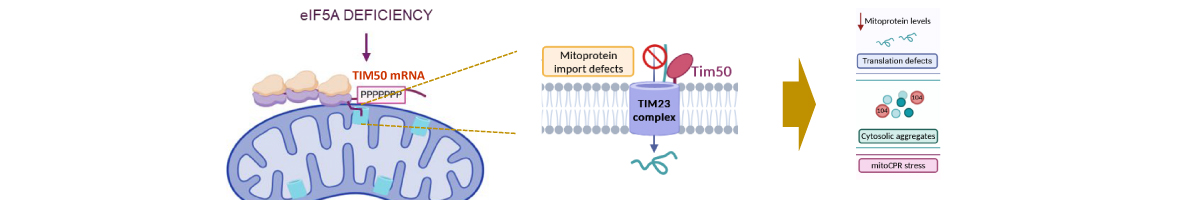
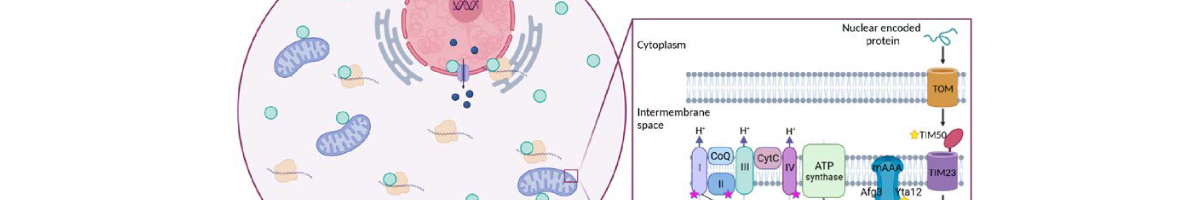
En esta tesis, se utilizó el organismo modelo la levadura Saccharomyces cerevisiae en ciernes para obtener conocimiento fundamental sobre una variedad de mecanismos moleculares utilizados por la célula para responder y adaptarse a los estímulos externos. En respuesta al aumento de la osmolaridad externa, la ruta de señalización MAPK High Osmolarity Glycerol (HOG) se activa para mediar cambios en diversas funciones celulares, incluyendo cambios en la acumulación de glicerol, la detención del ciclo celular, el restablecimiento de la homeostasis de iones y reprogramación global de la transcripción y traducción de todo el genoma, con el fin de lograr la adaptación. Tras la detección de alta osmolaridad externa, la señal se transduce a través de dos ramas funcionalmente redundantes pero mecánicamente distintas, SLN1 y SHO1, para finalmente activar el efector MAPK Hog1. Aunque múltiples interacciones entre sensores, proteínas adaptadoras y los componentes de señalización de la rama SHO1 se han descrito anteriormente, esta tesis caracteriza aún más la complejidad de los perfiles de las interacciones para dilucidar cómo la señal se propaga con eficacia y cómo se logra la fidelidad de la señal. En este sentido, utiliza el método nuevo M-track que detecta tanto las interacciones de las proteínas de corta duración y estables e hizo varias observaciones interesantes. En primer lugar, las señales de interacción entre Ste11 y muchos de los componentes de señalización ya se pueden detectar incluso en condiciones basales, en el que las señales aumentan después de la exposición al estrés. En segundo lugar, todas las interacciones de Ste11 requieren la presencia de la proteína-adaptador Ste50. En tercer lugar, la presencia de los osmosensores Msb2 y Hkr1 es necesaria para la interacción de Ste11 a Sho1 y a Pbs2. En cuarto lugar, nuestros resultados detectar, por primera vez, una interacción entre osmosensor Msb2 y Ste11, y que Msb2 puede funcionar como un concentrador individuo de Ste11 en la membrana plasmática. Por último, se observó la existencia de sistemas de retroalimentación negativos dirigidos a los niveles de proteína de Ste11 y Msb2 y también hacen alusión a los cambios en las tasas de disociación de complejos de señalización intermedias. Una vez que se transduce la señal de respuesta a estrés, Hog1 activado entra en el núcleo de la célula y, entre sus más destacados funciones aguas abajo, modula los cambios de expresión génica global. Dentro de minutos de shock, la tasa de transcripción global disminuye rápidamente en un 50%, sin embargo la maquinaria de transcripción se reasigna a los genes específicos implicados en la protección celular respuesta a estrés y su transcripción se induce rápidamente y altamente. El complejo de cap-binding complex (CBC), que está formado por las proteínas unidas a RNA Cbc1 y Cbc2, asociados con la caperuza 5 'del mensajero co-transcripcionalmente y ha sido descrito para funcionar en diversos aspectos de la vida de mensajero, incluyendo la transcripción. Utilizando ambas técnicas de biología molecular y genómica, describimos Cbc1 como regulador de la transcripción global tanto en condiciones de estrés y no estrés para mediar la expresión génica en la manera alta y rapida. En primer lugar, nuestros datos de Genomic Run-On (GRO) sugieren que Cbc1 se requiere para la reprogramación global de la transcripción tras el estrés osmótico. Específicamente, Cbc1 se requiere para la inducción rápida y alta de los genes de la respuesta a estrés durante la estimulación estrés osmótico. En segundo lugar, Cbc1 media el reclutamiento del complejo implicado en estrés osmótico Hot1/Hog1 a los promotores de estrés a través de una interacción directa con Hog1, que a su vez regula la formación de PIC y el reclutamiento RNAPII en los mismos genes. En tercer lugar, el papel transcripcional de Cbc1 se extiende también a la regulación de la expresión génica de las proteínas ribosomales (RP) tanto durante la recuperación de la transcripción RP siguiente estrés osmótico y para alta transcripción en condiciones normales, donde Cbc1 modula el reclutamiento de Rap1 a los promotores RP y por lo tanto posteriormente induce la formación de PIC. En cuarto lugar, utilizando los datos genómicos, Cbc1 parece conducir específicamente la transcripción de genes altamente inducidas en contraste con genes bajamente expresadas. Por último, nuestros resultados también apuntan a un posible papel de Cbc1 en la regulación del apagado de señalización, así como la estabilidad de los factores de transcripción. En respuesta a las feromonas de la célula del tipo de apareamiento contrario, la ruta MAPK feromona de la levadura se activa para mediar una serie de cambios fisiológicos en preparación para el apareamiento, incluyendo reprogramación de la expresión génica, la detención del ciclo celular, la formación de una proyección sexual denomina ¿shmoo¿, y en última instancia fusión celular de los tipos de apareamiento contrario. El factor de traducción eIF5A, esencial y conservada evolutivamente, se han descrito recientemente que funciona en la traducción de proteínas que contienen residuos de prolina consecutivos a través de su unión a ribomosomas para aliviar ribosoma estancamiento durante la formación del enlace péptidico entre dos prolinas. La activación de eIF5A requiere la adición de una modificación única post-traduccional, un residuo hipusina, que se deriva de espermidina, un factor esencial para la fertilidad de los mamíferos y se requiere para el apareamiento de levadura. Aquí se investigó eIF5A como un regulador de la respuesta a la feromona a través de la traducción de proteínas poli-Pro con papeles en el apareamiento. En esta tesis, lo primero que demuestra es que en respuesta a la feromona se requiere eIF5A hipusinado para la formación del shmoo, localización de componentes de la polarisoma, la inducción de proteínas de fusión celular y montaje de los cables de actina durante el crecimiento polarizado. También mostramos que eIF5A se requiere para la traducción de Bni1, una formina rica en prolinas implicada en la polimerización de actina durante la formación del shmoo. Nuestros datos indican que la traducción de los motivos poliprolina en Bni1 es eIF5A-dependiente y esta dependencia se pierde debido a la deleción de las poliprolinas. Además, un aumento en los niveles de proteína exógena de Bni1 restaura parcialmente el defecto en la formación del shmoo visto en mutantes de eIF5A. En conclusión, nuestro trabajo ofrece varias observaciones interesantes sobre la respuesta celular de la levadura a los estímulos externos. En respuesta a estrés osmótico, hemos caracterizado los perfiles de interacción de proteínas de varios componentes de señalización de la vía de HOG y proporcionado más ideas en cómo se transduce con rapidez y eficacia de la señal. Por otra parte, hemos identificado Cbc1 como un regulador transcripcional de la respuesta al estrés osmótico para inducir expresiones altas y rapidas de los genes implicadas al estrés osmótico a través del reclutamiento de los factores transcriptionales y el PIC. Además, Cbc1 también tiene funciones más generales para mediar alta expresión génica en condiciones normales sin estrés. Por último, nuestros resultados identifican eIF5A como un nuevo regulador esencial de apareamiento de levadura mediante la traducción de las forminas. Dado que eIF5A y forminas rica en poli-prolinas se conservan a través de especies, nuestros resultados también sugieren que la traducción de las forminas, dependiente de eIF5A, podría regular el crecimiento polarizado en procesos tales como la fertilidad y el cáncer en eucariotas superiores.
- Doctorado Internacional, Programa de Doctorado en Biomedicina y Biotecnología con Mención de Calidad.
-
Calificación: Sobresaliente Cum laude
-
Publicaciones:
Li et al., Genetics (2014), 197(4):1191-1200; Zuzuarregui*, Li* et al., BBA-GRM (2015), 1849(6):722-730; Li et al., BBA-GRM (2016),1859:405-419; Miguel et al., BBA-GRM (2013), 1829:1248-1255; Benet et al., BBA-GRM (2017), 1860:794-802. *Co-primeras autoras. -
Biblioteca de Ciencias "Eduard Boscà", Universitat de València.