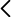- Universitat de València
- Università degli Studi di Torino
- Inserm Transfert
- Artero Allepuz, Ruben Dario
- PDI-Catedratic/a d'Universitat
- Piotr Konieczny
- Marina Marina Boido
- Giovanna Mendutti
- Camile Januel
- Cecile Martinat
La Atrofia Muscular Espinal (AME) es una enfermedad neurodegenerativa rara causada por la falta de la proteína Supervivencia de la Neurona Motora (SMN). La prevalencia de la AME es de 4/100.000 personas, y sus repercusiones clínicas van desde disfunciones motoras graves y mortalidad infantil hasta defectos menores con una esperanza de vida normal. Se han aprobado tres terapias para tratar la AME: Spinraza™, Evrysdi™ y Zolgensma™. Sin embargo, su elevadísimo coste (más de 200.000 euros por paciente y año) puede dificultar el acceso a ellas para la mayoría de los pacientes y supone una enorme presión financiera para los sistemas sanitarios nacionales. Además, estas terapias no están exentas de riesgos y limitaciones. Zolgensma™ está dirigido únicamente a los niños más pequeños y de diagnóstico rápido. Spinraza™ requiere una administración intratecal muy invasiva, que no siempre es posible. El mecanismo de acción utilizado por Evrysdi™ no permite restaurar completamente los niveles de SMN al nivel de un individuo sano. Además, aún no se ha confirmado el perfil de seguridad a largo plazo, y se ha visto que hay pacientes que no muestran mejora incluso tras años de tratamiento, llegando a empeorar. Cabe destacar que, en el caso de pacientes adultos, muchos de ellos ni siquiera reciben tratamiento, o este tiene una eficacia muy reducida. Así pues, los pacientes con AME siguen necesitando una terapia eficaz con un perfil toxicológico bien conocido a largo plazo y a un precio competitivo.
Investigadores del Departamento de Genética de la Universitat de València, de la Università degli Studi di Torino y del Inserm, han descubierto un fármaco aprobado por la FDA, el haloperidol, que tiene el potencial de convertirse en una terapia para pacientes con AME, o al menos para algunos subtipos de pacientes. Los investigadores han utilizado el método de reposicionamiento de fármacos para buscar nuevas terapias contra la AME. El haloperidol, un fármaco neuroléptico, se ha probado en ratones modelo de AME tipo II, muy utilizado en estudios preclínicos. Los resultados muestran un aumento de los niveles de SMN en la médula espinal y los músculos esqueléticos, lo que se traduce en una mejora de la fuerza y la destreza de los ratones tratados. También mejoraron la vida media y el aumento de peso de los animales tratados, y se mostró el efecto neuroprotector y antiinflamatorio a nivel de la médula espinal, lo que muestra un efecto del haloperidol dependiente e independiente de SMN. Adicionalmente, se han visto rescates sobre fenotipos que otros tratamientos no mejoran, como es el caso de las uniones neuromusculares (NMJ), o la supervivencia de motoneuronas, donde muestra un rescate superior. Cabe destacar que, no solo provoca cambios en el splicing SMN, sino que también aumenta sus niveles a nivel de transcrito, teniendo efectos también fuera del SNC. A diferencia de los tratamientos autorizados actualmente, se dispone de conocimientos detallados sobre el perfil de seguridad farmacológica del candidato a fármaco reasignado, que presenta un excelente perfil de seguridad y biodistribución en uso crónico. Los resultados obtenidos fueron coherentes en tres laboratorios diferentes, lo que confirma la reproducibilidad.
La principal aplicación de esta invención es en el sector farmacéutico, para el tratamiento de potencialmente todos los tipos de AME, incluidos los pacientes adultos, que ahora mismo no tienen tratamiento, y los pacientes con síntomas leves para los que el acceso a medicamentos costosos podría ser difícil, y sus cuidadores, a través de los sistemas sanitarios nacionales públicos o privados.
Las principales ventajas de la invención son:
- Excelente biodistribución a través de los tejidos animales.
- Difusión a través de la barrera hematoencefálica.
- Opción de tratamiento para pacientes adultos.
- Reducción de los plazos de desarrollo del nuevo fármaco candidato.
- Mayor tasa de éxito en el proceso regulatorio.
- Los medicamentos reutilizados pueden probarse en humanos a dosis seguras para evaluar su eficacia.
- Coste comparativamente inferior a los tratamientos alternativos.
- Posibilidad de nuevas vías de administración del tratamiento, ajustadas a las necesidades del paciente y disminuyendo las molestias.
- Patente concedida
Campus de Blasco Ibáñez
C/ Amadeu de Savoia, 4
46010 València (València)