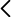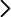Frasco de Franklin vertical con los componentes separados, soporte con pinza
Descripción

Tras completar la separación de componentes siguiendo las indicaciones de la Demo 167, el recipiente pequeño B (en posición inferior) contiene disolvente puro líquido y el superior A contiene tinte sólido (Fig. 1). Si se deja en dicha disposición con ambos recipientes a igual temperatura entonces se observa que las partículas sólidas de tinte actúan como núcleos de nucleación heterogénea para la condensación del vapor de disolvente. La nucleación heterogénea es uno de los fenómenos más importantes en física de nubes y esta demostración ayuda a comprenderlo.
Posteriormente se observa una lenta transferencia del disolvente desde el recipiente inferior B al superior A (Fig. 1). Es decir, el disolvente pasa de la fase líquida en que se encuentra puro, a la fase gaseosa y, de esta, a la disolución líquida. Se trata de una de las demostraciones más claras de la ley de Raoult. La presión de vapor de una disolución es menor que la del disolvente puro a la misma temperatura. En disoluciones diluidas, la ley de Raoult establece que la disminución de la presión de vapor es proporcional a la fracción molar de soluto (no volátil). La disminución de la presión de vapor se debe a que la disolución tiene más entropía que sus componentes puros a igual temperatura y presión.
En este demo tenemos una fase gaseosa en contacto con disolvente líquido puro del recipiente inferior B y con la disolución en A. Tras varios días en esta disposición se observa que el nivel de líquido en B va descendiendo y el de la disolución va aumentando. Esto indica que no hay equilibrio de distribución del disolvente entre la disolución en A, el líquido puro en B y la fase gaseosa, lo cual es una consecuencia de que el disolvente líquido puro tiene más tendencia a evaporarse que el disolvente de la disolución. El tinte no se evapora y permanece en A.
El potencial químico del disolvente en una fase mide la tendencia que tiene a salirse de ella y, en su tendencia hacia el equilibrio, pasar a otra fase donde el potencial químico del disolvente sea menor. Como vemos que el disolvente pasa del líquido puro en B a la disolución en A, podemos afirmar que el potencial químico del disolvente es menor en la disolución que como líquido puro. La fase líquida con mayor presión de vapor es aquella donde el potencial químico del disolvente es mayor. Esta demo ayuda así a comprender el significado del potencial químico de un componente en relación a los procesos de transferencia del mismo entre varias fases.
La preparación previa dura algo menos de 20 min si se “acelera” calentando el recipiente superior con un secador y usando una mezcla (frigorífica) de hielo picado y sal.
La condensación del vapor por el solo efecto de los núcleos de condensación y la transferencia de disolvente de una fase líquida a la otra son procesos muy lentos por lo que esta demostración solo se debe hacer en un aula en que exista la posibilidad de dejar el frasco durante semanas. Apreciar la lentitud del proceso observado es precisamente uno de los objetivos didácticos. El frasco es frágil pues sus paredes de vidrio son muy delgadas.
[1] J. A. Manzanares, B. Martínez, M. A. Gilabert, “Demostraciones de termodinámica con materiales simples: El frasco de Franklin vertical”, Rev. Esp. Fís. 34-3 (2020) 33–38.
[2] AP Chemistry Course video 69 de la CORE Collection creada por North Carolina School of Science and Mathematics (youtube v=PXYorrMu0Mw).