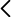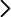Botella de plástico, agua, cerillas
Descripción
En primer lugar, hay que rellenar parcialmente la botella con agua, dejando un cierto volumen de aire (se puede rellenar aproximadamente hasta unos 2/3). Representa un sistema formado por agua líquida y gas (mezcla de aire con vapor de agua). Una vez tapada, se puede observar cómo al comprimir y descomprimir la botella (simplemente apretando y soltando) no se observa nada. Recordemos que al disminuir el vapor de agua su volumen, aumenta su presión, y por tanto aumenta su temperatura, y al descomprimir hay una expansión del aire y por tanto un enfriamiento (que en principio favorece unas condiciones de saturación). Sin embargo, en este caso vemos que no se produce ningún tipo de condensación., es decir, no se produce la formación de las gotitas necesarias para formar una “nube” (estamos ante un caso de nucleación homogénea). Ahora introducimos una cerilla encendida en la botella y la tapamos inmediatamente a continuación (para evitar que escape el humo), al repetir el proceso observaremos en este caso que al comprimirla no se produce condensación, pero ahora al dejar de presionar y aumentar su volumen se se observará la formación de una especie de niebla, por lo que en este caso la expansión y enfriamiento del aire es suficiente para alcanzar la saturación (se produce condensación). Podemos repetir el proceso (presionar la botella y dejar de presionarla) para observar como la “nube” aparece y desaparece (Figura 1).
Explicación
Historia

La primera creación de una nube dentro de un espacio cerrado se atribuye a Otto von Guericke (1602-1686), experimento que aparece descrito en su
famosa obra Experimenta Nova (publicada en 1672). En este experimento se conectaban dos grandes recipientes con aire en su interior separados por una
llave de paso. En uno de ellos se hacía el vacío, y al abrir la llave de paso se producía una corriente de aire de un recipiente al otro, apareciendo una niebla
en el interior de uno de los recipientes (Figura 2). Otto von Guericke intuyó que esto no ocurría únicamente en el interior de un recipiente, sino también en la
atmósfera dando lugar al proceso de formación de nubes. Von Guericke es conocido por sus estudios sobre la presión atmosférica, aspecto aún
desconocido en aquella época, y realizó el famoso experimento de los hemisferios de Magdeburgo (ver Demo 4).
Figura 2. Ilustración de la obra Experimenta nova en la que aparece el experimento de Otto von Guericke para generar una “nube” mediante el intercambio de aire entre dos recipientes realizando previamente el vacío en uno de ellos.
Fundamento teórico Si consideramos un recipiente cerrado con agua líquida, algunas de las moléculas de agua del líquido escaparán de su superficie, pasando a formar parte de una fase vapor. La presión ejercida por este vapor se conoce como presión (o tensión) del vapor de agua. También se producirá el proceso inverso, es decir, algunas de las moléculas de vapor de agua pasarán de nuevo a formar parte de la fase líquida. Cuando se alcanza el equilibrio entre estos dos procesos de evaporación y condensación, es decir, cuando el flujo de moléculas líquido-vapor se iguala con el flujo de moléculas vapor-líquido, se dice que se ha alcanzado la condición de saturación, y a la presión de vapor existente en este equilibrio se conoce como presión de saturación del vapor de agua (es). Esta presión de saturación únicamente depende de la temperatura, y a partir de la ecuación de Clausius-Clapeyron para la fase líquido-vapor es posible obtener la siguiente aproximación:
ln es ≈ a + b/T,
con a = 21,548 y b = 5388 K-1 , donde es viene dada en hPa (o mb) cuando la temperatura T se introduce en K. La relación entre la presión de vapor de agua (e) que existe bajo unas determinadas condiciones y su correspondiente valor saturado es aproximadamente igual a la humedad relativa (HR) del aire: HR = 100· e/es, de manera que en condiciones de saturación (e = es) la humedad relativa es del 100%. Cuando se supera el valor de la presión de saturación (e>es), se dice que el aire está sobresaturado, de forma que el porcentaje de sobresaturación se calcula como S = (1- e/es)·100. Nucleación homogénea: Una nube está formada por gotas de pequeño tamaño. Si consideramos únicamente la presencia de agua pura (proceso que se conoce como nucleación homogénea), para que se formen esas gotitas es necesario considerar un balance energético entre la propia energía involucrada en el proceso de condensación y la energía correspondiente a la tensión superficial debido a la curvatura de la gota. En este proceso lo que ocurre es que la presión de saturación del vapor de agua en la zona cercana a la gota (es,r) es superior al valor de saturación que se obtendría con respecto a una superficie líquida plana (es,∞), es decir, que la curvatura de la gota (r) implica un aumento del valor de la presión de saturación. La relación entre estas dos saturaciones viene dada por la ecuación de Kelvin:
es,r = es,∞·exp(a/r) ≈ es,∞·(1 + a/r)
(donde el valor de a depende de la temperatura). Cuando se utiliza la ecuación anterior para realizar una estimación de las sobresaturaciones necesarias para que se produzca una nucleación homogénea, se obtienen unos valores muy por encima de los valores de sobresaturación que se suelen encontrar en la atmósfera (en general inferiores al 1%).
Nucleación heterogénea:
Si en lugar de considerar que las gotitas de las nubes se forman a partir de condensación del vapor de agua sobre las propias moléculas de vapor de agua (nucleación homogénea) consideramos que estas gotitas se forman por condensación alrededor de una partícula (aerosol), los valores de sobresaturación necesarios son mucho más bajos que los estimados para el caso de nucleación homogénea. Este proceso se conoce como nucleación heterogénea, y en este caso la expresión para la presión de saturación (es,r) puede obtenerse combinando la ecuación de Kelvin y la ley de Raoult para tener en cuenta el cambio de presión en una gotita formada por una disolución (el agua actúa como disolvente, siendo el soluto la sustancia correspondiente al aerosol) en lugar de agua pura:
es,r ≈ es,∞·(1 + a/r – b/r3 )
-Mientras esté tapada la botella, se puede observar cómo apretando y soltando se va formando la “nube” y va desapareciendo. Si se abre el tapón y se continúa con el proceso apretar/soltar, se van formando “nubes” que escapan de la botella, hasta que finalmente el proceso se detiene ya que no quedan más aerosoles dentro de la botella. -Se puede añadir al agua alguna sustancia tensioactiva que facilite también el proceso de nucleación. -Se recomienda llevar ya la botella rellenada con agua a clase. -Para aumentar la cantidad de aerosoles se pueden introducir simultáneamente dos cerillas encendidas. -Si se comenta la revisión histórica sobre el experimento de Otto von Guericke, se puede hacer referencia también a la Demo 4.
-En ocasiones es difícil observar la niebla formada si la botella se observa desde lejos. -La nube formada se observa mejor si se introduce agua templada en lugar de agua fría
Se puede visualizar la realización de este experimento en el siguiente vídeo: https://www.youtube.com/watch?v=G70y90BVes4