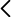Disolución acuosa de acetato sódico.
La bolsa del calientamanos contiene una disolución acuosa de acetato sódico en fase líquida. A la temperatura ambiente la disolución se encuentra en equilibrio metaestable (estado ● 1). Al hacer clic en una pieza metálica contenida en la bolsa se provoca la transición a la fase sólida. Se puede apreciar muy bien el avance de la transición líquido→sólido. Pasado un minuto todo el contenido de la bolsa se encuentra en fase sólida (estado ● 2) a la temperatura de 58 ºC.
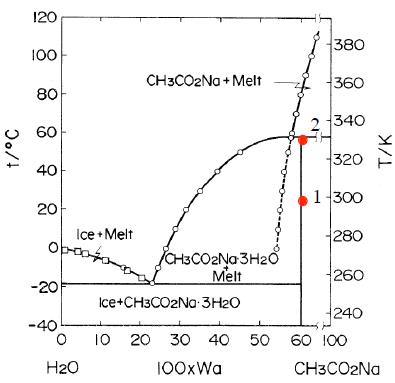
La Fig. 1 muestra el diagrama de fases de la mezcla H2O + CH3COONa [1]. Tres son las variables de estado de esta mezcla: temperatura T, presión p y fracción másica del soluto Wa = ma/(magua+ma). La líneas señaladas con círculos, líneas liquidus, separan dos regiones de la fase líquida: la de los estados estables y la de los estados metaestables. En fase sólida solo existen estados en equilibrio estable para Wa = 0% (hielo), Wa = 60%(acetato sódico trihidratado) y Wa = 100% (acetato sódico).
Un sistema en un estado metaestable tiende siempre a evolucionar espontáneamente a estados estables. Las disoluciones acuosas del acetato sódico pueden permanecer en estado metaestable largos periodos de tiempo (años).
Una disolución líquida en el estado 1, es una disolución en equilibrio metaestable. Al perturbar la disolución líquida con un clic, se forma un pequeño cristal de acetato sódico trihidratado que crece hasta que toda la disolución líquida se transforma en fase sólida. Entonces la temperatura del sólido alcanza los 58 ºC.
El proceso 1→2 es aproximadamente adiabático e isobárico, de modo que no hay variación neta de la entalpía específica de la mezcla. La entalpía liberada en la cristalización hcristalización = hsolido – hlíquido = -265 J g-1 se compensa con la del aumento de temperatura hsólido(T2) - hsólido(T1) = c(T2 – T1), donde c es la capacidad calorífica específica.
El proceso (líquido metaestable)→(sólido estable) que estamos observando es irreversible. En general, la variación del potencial de Gibbs de la mezcla, g = gsólido - glíquido, permite definir la afinidad del proceso A = -
g que varía con la temperatura: A(T) > 0 si T1 < T ≤ T2 , A(T2) = 0 y A(T) < 0 si T > T2.
Cómo se construye el diagrama de fases
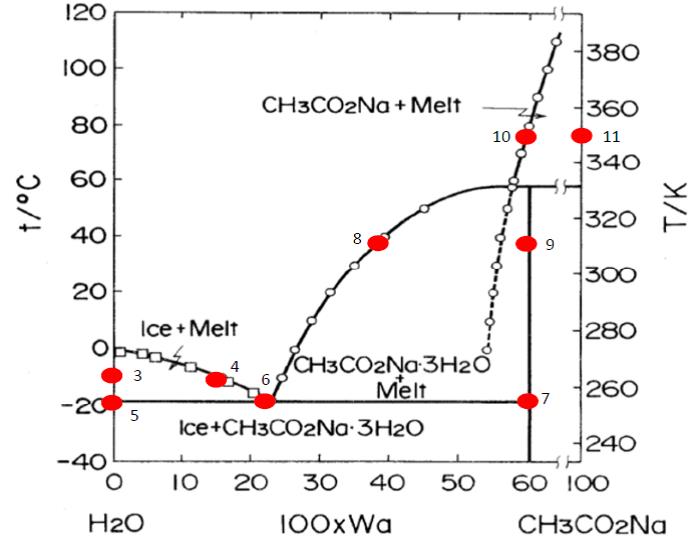
Midiendo la temperatura y la concentración de las fases líquida (L) y sólida (S) de los sistemas heterogéneos: 3(S)-4(L); eutéctico 5(S)-6(L)-7(S); 8(L)-9(S); 10(L)-11(S).
- T. Wada, Heat storage capacity of sodium acetate trihydrate during thermal cycling, Solar Energy 33 (1984) 373-375.
- B. Sandnes, The physics and chemistry of the heat pad, Am. J. Phys. 76 (2008) 546.
- J. B. Berg et alt., Thermal conductivity enhancement of sodium acetate trihydrate by adding graphite powder and the effect on stability of supercooling, Energy Procedia, 70 (2015) 249-256.