En 1913, el físico danés Niels Bohr publicó 3 artículos en los que proponía el primer modelo cuántico del átomo. El modelo daba una interpretación teórica al fenómeno de la espectroscopia y permitía interpretar cuantitativamente los rasgos fundamentales del espectro del átomo de hidrógeno. El modelo atómico de Bohr fue el primer intento de descripción cuantitativa de la estructura de la materia.
En 1913, el físico danés Niels Bohr publicó 3 artículos en los que proponía el primer modelo cuántico del átomo[1,2,3]. El modelo daba una interpretación teórica al fenómeno de la espectroscopia y permitía interpretar cuantitativamente los rasgos fundamentales del espectro del átomo de hidrógeno.
El modelo atómico de Bohr fue el primer intento de descripción cuantitativa de la estructura de la materia y fue la base de las primeras descripciones del enlace químico. Fue también el punto de partida de los desarrollos de la mecánica ondulatoria de Erwin Schrödinger y de la mecánica de matrices de Werner Heisenberg (que después sería su discípulo) que serían los modelos definitivos para interpretar la estructura de los átomos. Niels Bohr recibió el premio Nobel de Física en 1922 “por sus servicios en la investigación de la estructura de los átomos y de la radiación que de ellos emana”.[4]
A finales del siglo XIX, los científicos creían que el edificio de la física estaba prácticamente completo. Michelson, en 1899 (sólo un año antes del descubrimiento de Planck) había afirmado:
"Las leyes fundamentales más importantes y los hechos de la ciencia física han sido descubiertos todos; están establecidos tan firmemente que la posibilidad de ser sustituidos -como consecuencia de nuevos descubrimientos- es remota. Nuestros descubrimientos futuros sólo buscarán obtener la sexta cifra decimal".
Pero, solo un año después, se inició la revolución cuántica. En 1900, Max Planck propone una interpretación teórica de la distribución de la densidad de energía de radiación de un cuerpo negro [5] que puede considerarse el hito fundacional de la teoría cuántica, y que implicaba necesariamente que el intercambio de energía entre el cuerpo negro y la radiación no podía realizarse en forma continua sino en forma de paquetes discontinuos que se conocen desde entonces como "quanta" o cuantos de energía.
En 1905, Albert Einstein presentó una interpretación absolutamente revolucionaria y heterodoxa del efecto fotoeléctrico, que incluía la necesidad de extender el concepto de los cuantos de Planck a la propia naturaleza de la radiación.[6]
La hipótesis de Einstein se basa en que:
"...las observaciones asociadas con la radiación del cuerpo negro, fluorescencia, producción de rayos catódicos mediante luz ultravioleta y otros fenómenos relacionados, todos ellos conectados con la emisión o transformación de la luz, se entienden más fácilmente si uno supone que la energía de la luz está distribuida espacialmente en forma discontinua...”
contradiciendo las ideas establecidas a partir de las ecuaciones de Maxwell sobre la naturaleza ondulatoria (como ondas electromagnéticas) y, por tanto, continua, de la radiación.
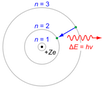
Para resolver la interacción de la radiación con la materia, conocida experimentalmente mediante el fenómeno de los espectros atómicos, Bohr perfeccionó el modelo planetario del átomo de Rutherford introduciendo el concepto de cuantos de energía de Planck-Einstein. El modelo de Bohr se basa en tres postulados:
1. Los electrones describen órbitas circulares en torno al núcleo del átomo sin radiar energía
2. Para los electrones en los átomos solo están permitidas aquellas órbitas cuyo radio cumpla que el momento angular del electrón sea un múltiplo entero de h/2π
3. El electrón solo emite o absorbe energía en los saltos de una órbita permitida a otra. En dicho cambio emite o absorbe un fotón cuya energía es la diferencia de energía entre ambos niveles.
Uno de los principales méritos del modelo de Bohr es que justifica las relaciones matemáticas entre los diferentes grupos de líneas espectrales, que habían sido encontradas empíricamente por Balmer y Rydberg. A pesar de que Bohr había intentado una teoría general de la constitución de todos los átomos y las moléculas, en la práctica solamente explicaba el átomo de hidrógeno. No obstante, los experimentos de Frank y Hertz (1914) y Stern y Gerlach (1922) demostraron respectivamente la existencia de los estados estacionarios postulados por Bohr y la cuantización espacial.
El modelo atómico no es la única aportación de Niels Bohr a la mecánica cuántica. Contribuyó decisivamente a la formulación de la conocida como “Interpretación de Copenhague” de la mecánica cuántica, considerada como la interpretación ortodoxa y que ha sido ampliamente confirmada por todos los experimentos posteriores. Es famosa su controversia con Einstein sobre la consideración de la mecánica cuántica como una teoría física completa.[7,8]
Desde un principio la interpretación de la teoría subyacente en la mecánica cuántica dividió a los físicos en dos escuelas que mantuvieron un encendido debate. Por una parte, los defensores de la "Interpretación de Copenhague", capitaneados por Bohr, entre los que se contaban Born, Heisenberg, Jordan, Pauli y Dirac. Por la otra, "los caballeros del continuo", acaudillados por Einstein y entre los que se cuentan algunos más de los padres de la mecánica cuántica, como Schrödinger, De Broglie, Planck, Von Laue y Landé.
El fondo de la cuestión reside, en palabras de Einstein, en si la mecánica cuántica es una "teoría completa". En cualquier caso, la controversia se centró en varios aspectos de la interpretación de la mecánica cuántica, no en la capacidad de ésta para predecir datos experimentales. Einstein, el más representativo de los físicos contrarios a la interpretación de Copenhague dice:
"…esta interpretación no describe qué sucede realmente entre las observaciones o independientemente de ellas. Pero algo debe suceder, esto no lo podemos dudar; este algo no necesita estar descrito por electrones o cuantos u ondas, pero a menos que se le describa de alguna manera, el objetivo de la física no está completo. No puede admitirse que se refiera solo al acto de la observación. El físico debe postular en su ciencia que está estudiando un mundo que él mismo no ha hecho y el cual estaría presente, esencialmente idéntico, si no estuviéramos aquí. Por tanto, la interpretación de Copenhague no ofrece un entendimiento real de los fenómenos atómicos".
Para la escuela de Copenhague, las relaciones de indeterminación son una restricción asociada al proceso de medición que no reflejan las limitaciones del aparato de medida, sino que es intrínseca al mismo proceso de medida y que, por tanto, no desaparecerá con los avances de la técnica de medida. Representa una limitación de carácter fundamental que se aplica permanentemente y, por tanto, constituye un principio de la naturaleza, porque solo es accesible al conocimiento el sistema en interacción con el observador. Como dice Heisenberg, los que se oponen a la interpretación de Copenhague:
"...prefieren retornar a la idea de un mundo objetivo real, cuyas partes más pequeñas existen objetivamente, como las piedras y los árboles existen, independientemente de que los estemos observando o no. Esto, sin embargo, es imposible, o al menos no enteramente posible, a causa de la naturaleza de los fenómenos atómicos".
El comportamiento de una partícula cuántica es intrínsecamente estadístico, sin que quepa la consideración de las causas de tal comportamiento; este fenómeno no es analizable. Por tanto, como concluye el propio Bohr:
"...la mecánica cuántica lleva implícita la necesidad de renunciar definitivamente al ideal clásico de la causalidad"
Referencias:
1.- Bohr N. "On the constitution of atoms and molecules" Philosophical Magazine 26 (1913) 1-25
2.- Bohr N. "On the constitution of atoms and molecules" Philosophical Magazine 26 (1913) 476-502
3.- Bohr N. "On the constitution of atoms and molecules" Philosophical Magazine 26 (1913) 857-875
4.- http://www.nobelprize.org/nobel_prizes/physics/laureates/1922/press.html
5.- Planck M. "Sobre la teoría de la ley de distribución de la energía del espectro normal" Verhandlungen der Deutschen Physikalischen Gesellschaft 2 (1900) 237-245
6.- Einstein A. "Un punto de vista heurístico acerca de la creación y transformación de la luz", Annalen der Physik 17 (1905) 132-148
7.- Bohr, N. "Can Quantum-Mechanical Description of Physical Reality be Considered Complete?" Physical Review 48 (1935) 696-702
8.- Einstein, A., Podolsky B. and Rosen, N. "Can Quantum-Mechanical Description of Physical Reality be Considered Complete?" Physical Review 47 (1935) 777-780
Más información:
Sobre el modelo atómico de Bohr:
http://es.wikipedia.org/wiki/Modelo_atómico_de_Bohr
Sobre Niels Bohr:
http://es.wikipedia.org/wiki/Niels_Bohr















