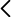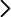Cilindro adiabático provisto de pistón extraíble.
En un proceso de compresión adiabática se produce un aumento de la temperatura del sistema. En efecto, según el Primer Principio de la Termodinámica:
donde es la variación de energía interna, Q la energía en forma de calor y W el trabajo intercambiados por el sistema. Para un proceso adiabático (Q=0):
Si se considera el aire interior del cilindro como un gas ideal, en primera aproximación, se tiene que siendo n el número de moles de gas, cV el calor molar a volumen constante y
la variación de temperatura del sistema. Por otro lado, si el proceso de compresión es rápido se considera irreversible, en cuyo caso
, donde pext es la presión ejercida exteriormente sobre el sistema y
la variación de su volumen. Por tanto de la ecuación anterior se obtiene:
Es claro que una disminución importante del volumen lleva a un aumento apreciable de la temperatura del sistema.
En el caso que nos ocupa, la demostración consiste en mostrar el aumento de temperatura “incinerando” una pequeña fibra de algodón. Se usa un cilindro en el que hay encajado un pistón móvil. En primer lugar hay que desenroscar y extraer el pistón, e introducir una pequeña fibra de algodón. Se vuelve a colocar el pistón, se enrosca y se empuja suavemente hacia abajo para hacer descender la fibra. Una vez hecho esto, se levanta el pistón lo máximo posible y se le da un golpe fuerte, seco y rápido hacia abajo puesto previamente el cilindro sobre una superficie firme. Si se hace correctamente, se produce un vistoso llamarazo causado por el súbito aumento de la temperatura del aire interior que quema literalmente el algodón.
Podemos estimar aproximadamente el aumento de temperatura del aire que se produce en la compresión adiabática si suponemos que ésta es reversible. En este caso se cumple que
siendo g la constante adiabática (=1,4 para el aire). Considerando los estados inicial (i) y final (f), tenemos
Tomando los datos realistas Ti=293 K y Vi/Vf=5, se obtiene una temperatura final del aire Tf=558 K. La temperatura de combustión del algodón es de unos 508 K.
- Es importante que la posición inicial del pistón sea lo más alta posible, para garantizar una disminución máxima del volumen.
- Conviene reducir un poco la iluminación del aula para ver mejor el llamarazo.
- Después de la combustión conviene abrir el cilindro y limpiarlo de los restos que haya podido quedar.
1. En la experiencia realizada se cumple que:
- DU ≠ 0, Q = 0, W > 0
- DU ≠ 0, Q ≠ 0, W > 0
- DU < 0, Q = 0, W < 0
- DU ≠ 0, Q = 0, W < 0
2. Así mismo, el algodón se quema:
- porque todo el trabajo realizado sobre el sistema se convierte en calor.
- porque la presión alcanzada es tan grande que el algodón se volatiliza.
- porque es un proceso irreversible, en un proceso reversible no sucedería.
- porque todo el trabajo se invierte en aumentar la energía interna, y por tanto su temperatura.
3. Así pues, del resultado del experimento podemos concluir que en una comprensión adiabática de un gas ideal…
- la temperatura se mantiene constante.
- la temperatura aumenta.
- la temperatura disminuye.
- la temperatura puede aumentar, disminuir o mantenerse constante.
4. Sabiendo que el proceso es adiabático, el aire se puede considerar un gas diatómico y la temperatura de combustión del algodón es de 285ºC, ¿En qué factor hay que reducir al menos el volumen para que se produzca la combustión?
- Al menos a la mitad
- Un tercio.
- Un factor 5.
- Una décima parte.
5. ¿Cuál de las siguientes afirmaciones es falsa?
- En un proceso adiabático no se cede calor al sistema.
- En un proceso adiabático la energía interna permanece constante.
- En un gas ideal, la variación de energía interna solo depende de la variación de la temperatura.
- Todos los procesos adiabáticos son irreversibles.
6. En una transformación adiabática, el trabajo realizado sobre el sistema
- Aumenta su energía interna.
- Aumenta el calor
- Disminuye su energía interna
- Aumentan el calor y la energía interna.
Autores: Enric Valor y Juan Zúñiga