Hielo, sal, recipiente de un litro, termo de un litro, termómetro desde -50 ºC hasta -200 ºC, agitador.
Procedimiento
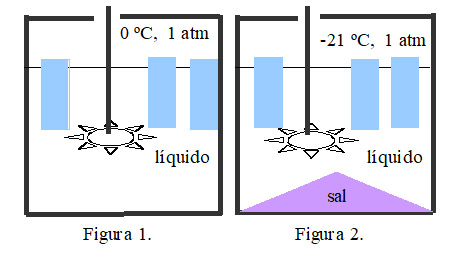
La experiencia comienza observando los 0 ºC del equilibrio estable [hielo + agua líquida] (Fig. 1). Al echar sal (NaCl) la temperatura desciende hasta alcanzar los –21 ºC del equilibrio estable [hielo +disolución líquida + sal] (Fig. 2) llamado punto eutéctico.
El modo de operar es el siguiente: 1) llenar el recipiente con hielo, sin añadir agua líquida; 2) comprobar que la temperatura es 0 ºC; 3) echar la sal sobre el hielo (más del 30 % del volumen del hielo); 4) mezclar bien usando el agitador; 4) comprobar que la temperatura ha descendido por debajo de los -10 ºC. Para alcanzar la temperatura de –21 ºC se requiere mejorar el aislamiento térmico.
Explicación
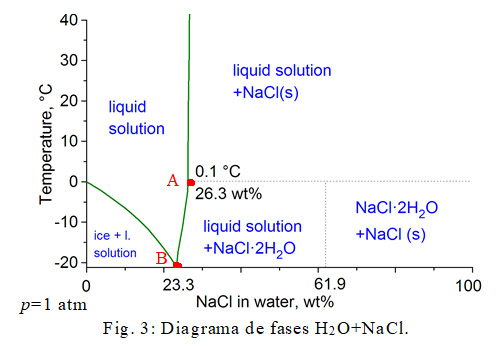
H2O+NaCl.
Este proceso espontáneo se explica teniendo en cuenta el diagrama de fases H2O + NaCl a la presión de 1 atm (Fig. 3). La concentración es la fracción másica de la sal en %, es decir wt=100 x msal/(magua+msal). Al echar la sal sobre el hielo se suceden tres procesos: 1) se forma la disolución líquida A (ver punto rojo en Fig. 3); 2) esta disolución funde el hielo; 3) la temperatura de todo el sistema desciende a -21 ºC (punto rojo B).