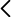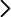Botella de 1 L DEN-460 Poly Density Bottle que contiene "agua salada", propan-2-ol y cuentas de plástico blancas y azules de distinta densidad.
Descripción
Las mejores demostraciones de aula consiguen captar la atención del alumnado porque muestran un efecto inesperado o contra-intuitivo (alias discrepant events). Aquí se les presenta una botella agitada en la que cuentas azules y blancas se entremezclan en una mezcla de agua y alcohol y se les pide que anticipen qué va a ocurrir cuando se deje reposar la botella. La sucesión que observan es inesperada (Fig. 1). Cuando se les permite asentarse, las cuentas se separan, situándose las blancas en la parte superior y las azules en la inferior. Pero lentamente las cuentas se van acercando hasta que se encuentran en el centro de la botella, manteniéndose las blancas en la parte superior. Es curioso ver las cuentas flotando en medio de un líquido y, sobre todo, es difícil de asimilar y les obliga a razonar. El estudio de la región de miscibilidad líquido-líquido no solo ayuda a entender el equilibrio de fases sino también los fenómenos críticos. En el Laboratorio de Termodinámica se dispone de prácticas para estudiar los equilibrio de aguaetanol y agua-fenol. Sabemos que agua y etanol son completamente miscibles mientras que agua y fenol tienen una región de inmiscibilidad con una temperatura crítica superior de 68 ºC. Esta región de inmiscibilidad se ensancha (y la temperatura crítica aumenta) si añadimos un poco de NaCl (digamos un 2 % en masa). Es decir, las solubilidades del agua en fenol y del fenol en agua se reducen al añadir sal. Agua y propan-2-ol son completamente miscibles a temperatura ambiente, pues pueden formar enlaces por puentes de hidrógeno. De hecho, su entalpía de mezcla es negativa para una fracción molar de agua superior al 50 %, lo que indica que esta mezcla es muy estable porque está favorecida entálpicamente y entrópicamente. Ahora bien, la adición de una suficiente cantidad de NaCl puede hacer que esa mezcla se vuelva inestable y que el estado de equilibrio del sistema tenga dos fases líquidas. (Si la cantidad de sal es mayor, puede haber una fase líquida y otra sólida o dos fases líquidas y una sólida; la fase sólida aparece cuando se supera el límite de solubilidad de la sal.) Este fenómeno se conoce como expulsión salina (salting out) porque parece que la adición de la sal expulsa al propan-2-ol del "agua salada" y los hace líquidos inmiscibles. Este fenómeno es bastante general y se emplea como método de purificación por extracción: la adición de sal reduce la solubilidad en agua de las moléculas orgánicas, de modo que estas se separan como una segunda fase líquida. Por supuesto, la separación es solo parcial y las dos fases líquidas inmiscibles contienen los tres componentes, si bien una fase (α) es más rica en agua y sal y la otra fase (β) es más rica en propan-2-ol (aunque también contiene agua y sal). Las dos fases líquidas son transparentes. La interfase podría verse si se añade algún colorante (como se hace en el artículo y vídeo de la Ref. [1], pero en esta demostración la visualización se realiza con cuentas de plástico de colores. Cuando la fracción molar de agua es superior al 50 %, su interacción con el propan-2-ol está favorecida entálpicamente por la formación de enlaces por puentes de hidrógeno (Fig. 2a). La mezcla del agua con un electrólito como NaCl también está favorecida entálpicamente. Las moléculas de agua en una disolución iónica tienden a formar capas de hidratación compactas alrededor de los iones (Fig. 2b). La intensa interacción atractiva ion-dipolo hace que el agua prefiera estar en una fase líquida rica en sal. Como las moléculas de agua que rodean los iones no están disponibles para rodear a las moléculas de alcohol resulta que, cuando la fracción de agua no es muy grande, la minimización de la energía libre se consigue con dos fases líquidas (Fig. 3); es decir, la inestabilidad aparece cuando no hay bastante agua para solvatar tanto a los iones como a las moléculas de isopropanol. Si se añade más agua, puede volver a formarse una única fase [1]. El efecto de la entropía de mezcla hace que las dos fases líquidas tengan tres componentes.
La botella se puede adquirir a través de Educational Innovations Inc. (https://www.teachersource.com/product/poly-density-kit/density) o de Arbor Scientific (https://www.arborsci.com/products/poly-density-bottle). La botella vino con 84.7 g de NaCl añadimos 440.5 mL de agua destilada y 409.5 mL de propan-2-ol puro. Para ampliar los conocimientos sobre miscibilidad resulta interesante acabar planteando la pregunta ¿cuántas fases líquidas inmiscibles podemos tener simultáneamente en un recipiente? Pocos estudiantes anticiparan que se pueden tener hasta 10, como se ilustra en el frontispicio del clásico de J. L. Hildebrand y R. L. Scott, Regular Solutions, (Prentice-Hall: Englewood Cliffs, 1962). Tras mostrarles alguna imagen (como la Fig. 3 de la Ref. [4]) se les puede recomendar la lectura de esa referencia u otra más elemental (doi:10.1021/ed068p655). Existe una variante de esta demostración que usa dos latas de refresco de cola, una light y otra clásica, en lugar de cuentas de plástico de distinta densidad [4].
El isopropanol debe manipularse con guantes y gafas.
[1] E. C. Person, D. R. Golden, B. R. Royce, “Salting effects as an illustration of the relative strength of intermolecular forces”, J. Chem. Educ. 87 (2010) 1332-1335. [2] V. Gomis, F. Ruiz, G. de Vera, E. López, M. D. Saquete, “Liquid-liquid-solid equilibria for the ternary systems water- sodium chloride or potassium chloride- 1-propanol or 2- propanol”, Fluid Phase Equilibria 98 (1994) 141-147. [3] J. C. Williamson. "Liquid–liquid demonstrations: Phase equilibria and the lever rule", J. Chem. Educ. 98 (2021) 2356–2363. [4] K. Lyle. "Demystifying the poly density bottle".Chem 13 News (2013) https://uwaterloo.ca/chem13-news-magazine/march-2013/feature/demystifying-poly-densitybottle (accedida 15/6/2023).