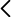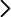Frasco de Franklin vertical.
Descripción
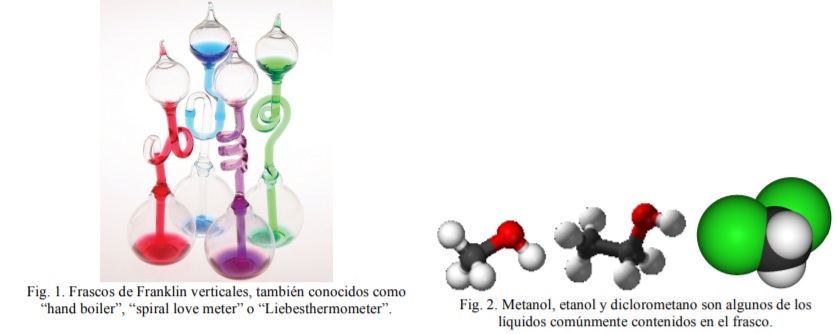
El tubo de Franklin vertical (Fig. 1) tiene un recipiente grande A en su extremo inferior y otro menor B en su extremo superior, conectados por un tubo vertical que parte del fondo de B y penetra en A hasta llegar a unos pocos milímetros de su base. El recipiente A tiene aproximadamente un 20 %-40 % de su volumen lleno de un disolvente coloreado con tinte (Fig. 2). La fase gaseosa es una mezcla de “aire seco” y vapor del disolvente. El requisito esencial para esta demostración es tener la mano más caliente que el líquido del recipiente. A mayor diferencia de temperatura, más intenso es el efecto. Al tocar el recipiente A con la mano se observa que el líquido comienza a ascender por el tubo. Si la mano está suficientemente caliente entonces el recipiente B se llena y, tras alcanzar el nivel del líquido la parte inferior del tubo, se observa un borboteo de burbujas que ascienden por el tubo. El nombre “hand boiler” se asocia, erróneamente, a la idea de que se consigue hacer hervir el líquido con la mano. En realidad, el disolvente siempre está en equilibrio líquido-vapor y su calentamiento provoca un desplazamiento del equilibrio hacia estados de mayor entropía, es decir, hacía una mayor cantidad de sustancia en fase vapor.
La ley de Charles afirma que, a presión constante, el volumen de un gas ideal aumenta proporcionalmente a la temperatura. La ley de Gay-Lussac afirma que, a volumen constante, la presión de un gas ideal aumenta proporcionalmente a la temperatura. Ahora bien, estas leyes no permiten explicar correctamente las observaciones porque no tienen en cuenta el aspecto más importante: la evaporación del disolvente en el recipiente A y la condensación de su vapor en el recipiente B. Es más, las leyes de los gases ideales pueden llevar a conclusiones erróneas pues, por ejemplo, un aumento de temperatura del recipiente A provoca que la presión parcial del disolvente aumente pero la presión parcial del aire seco en A puede disminuir cuando aumenta la temperatura porque el ascenso del líquido hace que aumente el volumen disponible para el aire seco.
Los instrumentos como el frasco de Franklin se empezaron construir poco después de descubrirse que “los vapores son mucho más elásticos que los gases” [1], es decir, que tienden a expandirse mucho más que los gases, porque el calentamiento no solo provoca una expansión de la fase gaseosa sino también un desplazamiento del equilibrio líquidovapor hacia la evaporación. La ecuación de Clausius-Clapeyron describe la variación de su presión de vapor con la temperatura T. Como su entalpía molar de vaporización es mucho mayor que la energía térmica molar, resulta que la presión de un vapor saturado aumenta exponencialmente con T, mientras que la presión de un gas a volumen constante aumenta linealmente con T. La variación exponencial de la presión de vapor con T se ilustra claramente con esta demostración, pues el nivel del líquido es muy sensible incluso a muy pequeños cambios de temperatura provocados por el contacto con la mano.
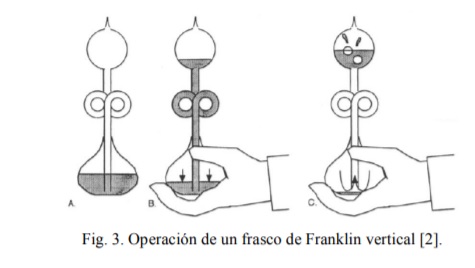
La explicación de la operación del frasco de Franklin vertical (Fig. 3) requiere tener en cuenta algo más que la variación de la presión de vapor con la temperatura. Solo con la ecuación de Clausius-Clapeyron que describe dicha variación no es posible explicar la diferencia observada en el nivel del líquido en los recipientes A y B. Además de la ecuación hidrostática y de la ecuación de Clausius-Clapeyron, hay que tener en cuenta que en el recipiente B ocurre la condensación del vapor [3]. De no ser por esta condensación, la presión en el recipiente superior B aumentaría tanto que el líquido no podría ascender por el tubo vertical.
En definitiva, esta simple demostración ilustra varios fenómenos cuya discusión puede realizarse en varios niveles de complejidad, todos ellos enmarcados en el curso introductorio de física.
Introducir el frasco de Franklin en un frigorífico durante unos minutos antes de usarlo.
El frasco es frágil pues sus paredes de vidrio son muy delgadas.
[1] J. Clayton, “An experiment to prove that water, when agitated by fire, is infinitely more elastic than air in the same circumstances”, Phil. Trans. Royal Soc. 41 (1739) 162–166.
[2] R. Becker, J. Becker, “An inexpensive, closed-system distillation apparatus”, Chem 13 News 245 (1996) 4–5.
[3] J. A. Manzanares, B. Martínez, M. A. Gilabert, “Demostraciones de termodinámica con materiales simples: El frasco de Franklin vertical”, Rev. Esp. Fís. 34-3 (2020) 33–38.