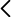Dos tubos de ensayo con mezclas de agua y fenol (con fracciones másicas del 15 % y del 60 % de fenol), agua caliente y termo de café (o agua y calentador de agua portátil para demostraciones), vaso de precipitado de 100 mL, termómetro digital.
Descripción
Se tienen preparados dos tubos con fracciones másicas del 15 % y del 60 % de fenol en agua. A temperatura ambiente, en cada tubo el equilibrio se alcanza con dos fases líquidas inmiscibles, que difieren en la concentración de fenol.
Ambas fases son transparentes (aunque una de ellas con coloración anaranjada), lo que evidencia que cada una de ellas es una mezcla líquida homogénea. En el primer tubo, hay una fase rica en fenol de muy poco volumen en el fondo y otra de mucho mayor volumen con menor concentración de fenol en la parte superior. En el segundo tubo, hay una fase rica en fenol que ocupa casi todo el tubo y otra encima de mucho menor volumen y menor concentración de fenol.
Estos tubos se llevan a clase para que los estudiantes observen que agua y fenol forman dos fases líquidas inmiscibles en estas condiciones de presión 1 atm, temperatura de unos 20 ºC y las fracciones másicas de fenol indicadas (15 % y 60 %) (imagen A). Conviene no agitarlos para que se observe bien la separación de fases.
Al agitar cada uno de los tubos se observa que se forma una mezcla líquida heterogénea de aspecto lechoso (imagen B). Se trata de una emulsión con gotitas muy finas de una fase en la otra que dispersan la luz y por ello se ven turbias. Si se dejase en reposo, las fases volverían a separarse y ser transparentes (al cabo de unas horas).
En el vaso de precipitado ponemos agua caliente (preferiblemente, alrededor de 75 ºC) que hemos traído en un termo de café. Introducimos los tubos que habíamos agitado. Al cabo de un rato se forma en cada tubo una única fase homogénea transparente que no se vuelve lechosa aunque lo agitemos de nuevo. Con estas proporciones de agua y fenol, por encima de unos 55 ºC, agua y fenol son completamente miscibles y forman una única fase líquida homogénea (imágenes C y D). Si se enfrían, las fases vuelven a separarse, lo que se aprecia porque comienzan a tener un aspecto lechoso (por la dispersión de la luz al formarse gotitas de una fase en la otra).
Un aumento de temperatura siempre favorece los estados de mayor entropía. El estado de una fase homogénea tiene más entropía que el de dos fases líquidas separadas. La mayoría de líquidos son miscibles. Para que dos componentes sean inmiscibles a temperatura ambiente es necesario que la formación de su mezcla sea bastante endotérmica, es decir, que implique un aumento de entalpía. Agua y fenol en las condiciones iniciales de estos dos tubos forman dos fases separadas (y decimos que tienen miscibilidad parcial, pues en cada fase hay tanto agua como fenol, pero las fases tienen distinta composición). A cualquier temperatura, presión y concentración de fenol el estado del sistema es siempre el de menor potencial de Gibbs. A temperatura ambiente el mínimo del potencial de Gibbs se consigue con dos fases separadas, pero a una temperatura mayor, por encima de unos 55 ºC, el mínimo del potencial de Gibbs se consigue con una única fase homogénea. Esta fase homogénea tiene más entropía (y energía) que las dos fases separadas. A temperaturas bajas domina la contribución energética y el equilibrio se alcanza con dos fases líquida inmiscibles. A temperaturas mayores domina la contribución entrópica y el equilibrio se alcanza con una única fase líquida. Un aumento de temperatura siempre provoca un desplazamiento del equilibrio hacia estados de mayor entropía.



En principio, no hay riesgo puesto que a clase se lleva un tubo cerrado. Ahora bien, como el fenol es tóxico, si se rompiese el tubo debería limpiarse rápidamente y ventilar el aula. La cantidad de fenol en el tubo es muy pequeña y su toxicidad disuelto en agua es moderada, por lo que el riesgo es bajo.
Dill KA, Bromberg S, Stigter D. Molecular Driving Forces. Statistical Thermodynamics in Biology, Chemistry, Physics, and Nanoscience, 2.a Edition, Garland Science, 2011, cap. 32.