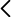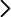Bote de bebida carbonatada, sal y recipiente de dos litros.
Procedimiento
Se vierte la bebida carbonatada (gaseosa, cerveza, coca cola, tónica, etc) en un recipiente. Esta operación se procura hacer con cuidado evitando formar espuma. Este líquido se encuentra en un estado de equilibrio metastable, con un exceso de CO2. Una observación atenta muestra que se forman burbujas de CO2 en las paredes del recipiente: la tensión superficial de la interfase líquido-vapor impide que se formen en la masa del líquido. A continuación se echan unos 50 cm3 de sal, que provoca la formación explosiva de burbujas, triplicando el volumen inicial de la bebida. Al echar la sal hemos sembrado con núcleos sólidos el interior del líquido. Ahora las burbujas se forman en estos núcleos y el líquido pierde rápidamente el exceso de CO2.
Explicación
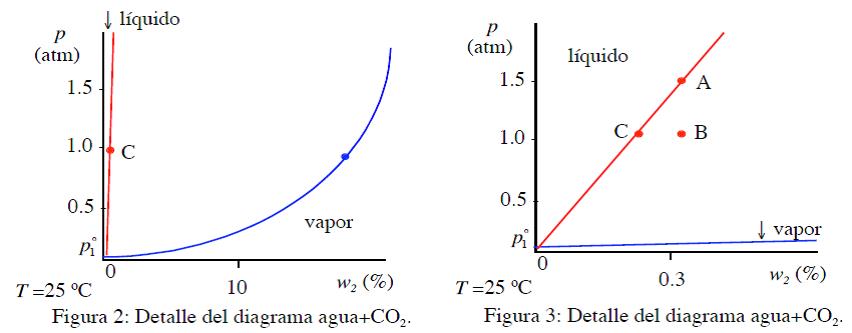
Admitimos que la bebida carbonatada es una mezcla de agua (componente 1) y anhídrido carbónico (componente 2). En la Fig. 1 se muestra el diagrama de fases a la temperatura de 25 ºC en función de la presión y de la fracción másica w2=100 x m2/(m1+m2). Cuando coexisten ambas fases la concentración de la líquida es la de la línea liquidus (roja), y la concentración de la fase vapor es la de la línea vapor (azul). Los valores de la presión de vapor de los componentes puros son pº1=0.031 atm y pº1=63.4 atm.
Un estado típico de la fase líquida en estas bebidas es el A (Fig. 3), es decir 1.5 atm y (w2)A=0.32 %. Al abrir la lata la presión se reduce a 1.0 atm y la fase líquida pasa al estado B, en equilibrio metaestable, con un exceso de CO2. Entonces se genera un proceso espontáneo para reducir la concentración de la disolución líquida, expulsando vapores ricos en CO2, que tienen la concentración (w2)vapor=18 % (ver Fig. 2).
Estos vapores salen al ambiente directamente a través de la interfase líquido-vapor, o indirectamente generando burbujas. De este modo el estado de la fase líquida en el diagrama (Fig. 3) se va desplazando desde B hasta llegar a C, en donde termina la formación de burbujas. Es un proceso lento que puede durar horas. Este proceso se acelera al añadir la sal. Ahora las burbujas se forman en todo el interior de la disolución, no solo en las paredes.