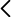Campana de vacío, tubos con válvulas anti-retorno, jeringa de 60 ml, globos, vaso transparente, agua caliente, sal.
-
Hinchar un globo sin soplar:
- Se introduce un globo deshinchado y anudado en el interior de la campana de vacío.
- Se colocan los tubos de evacuación y la jeringa tal y como se muestra en la figura superior.
- Retirando el émbolo de la jeringa se extrae el aire de la campana y las válvulas anti-retorno impiden que vuelva a ella.
- A medida que se extrae el aire y se hace el vacío en la campana el globo va hinchándose.
Estamos acostumbrados hinchar globos insuflando aire en su interior de manera que la presión en su interior aumente y dado que sus paredes son flexibles, éstas se expanden hasta restablecer el equilibrio mecánico (la presión interior es igual a la presión exterior que normalmente es la presión atmosférica).
Al inicio de la experiencia, la presión interior del globo es la presión atmosférica. La presión exterior, que empieza siendo la atmosférica, va disminuyendo a medida que se va extrayendo el aire del interior de la campana. El equilibrio de presiones requiere que disminuya la presión dentro del globo y ello ocurre aumentando el volumen del globo, es decir, hinchándose.
-
Cocer un huevo en el Everest
- Se vierte agua caliente en el vaso transparente.
- Se colocan los tubos de evacuación y la jeringa tal y como se muestra en la figura superior.
- Retirando el émbolo de la jeringa se extrae el aire de la campana y las válvulas anti-retorno impiden que vuelva a ella.
- Cuando la presión en el interior de la campana desciende convenientemente, el agua del vaso entra en ebullición.
- La experiencia se puede repetir con una disolución de agua y sal.
El punto de ebullición es la temperatura a la cual la presión de vapor de un líquido es igual a la presión atmosférica. Como se muestra en la figura, tanto para agua pura (línea continua) como para disoluciones (línea punteada) la presión aumenta con la presión.
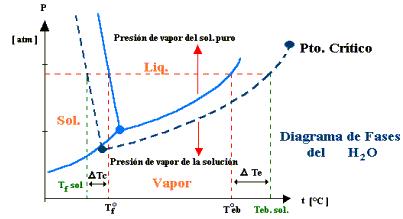
Para calcular cuantitativamente la variación que hay entre el punto de ebullición normal y el punto de ebullición a una presión atmosférica distinta se puede aplicar la ecuación de Sidney-Young:
Cambio en el punto de ebullición
Constante de Sidney-Young que depende de la polaridad del líquido y es 0.00012 (si es polar) y 0.0001 (si es no polar) con las presiones en mmHg y las temperaturas en grados Celsius (°C).
- Se recomienda realizar antes la demo 4 (semiesferas de Magdeburgo) para poner en evidencia que, debido a la existencia de la atmósfera en la que estamos inmersos, actúa una presión hidrostática sobre todos los cuerpos que se encuentran en ella. Por ejemplo, los hemisferios de la demo 4, los globos o el agua. Y que esta presión se puede reducir y ver el efecto que produce.
- Una pregunta clásica en muchos cursos de Física general es si es posible cocer un huevo en la cima del Everest. Para contestarla hay que conocer la temperatura a la que se cuece un huevo (70 oC para que cuaje la yema) y la presión atmosférica a esa altura (238 mmHg) y aplicar la ecuación anterior.
- También se puede disolver algún tipo de sal en el agua para comprobar la elevación del punto de fusión de una disolución.
Para empezar a realizar vacío es necesario sujetar fuertemente la campana contra la base mientras se extrae el aire con la jeringa, de forma que la campana sea estanca.
Asegurarse de que el o-ring se encuentre en la posición correcta, en su hueco.
El agua caliente para b) se puede obtener de un dispensador de agua o se puede calentar en un horno a microondas de uso público (el de estudiantes de la fac. de física, por ejemplo).
1. Al extraer el aire de la campana con la jeringa la presión en el interior de la campana
- sigue siendo la atmosférica
- sigue siendo la misma pues el volumen no cambia
- disminuye.
- aumenta.
2. Al extraer el aire de la campana con la jeringa la presión en el interior del globo
- sigue siendo la atmosférica.
- aumenta pues el globo se hincha.
- disminuye pues disminuye la presión externa.
- es constante pues el aire no puede salir.
3. Al extraer el aire de la campana, el globo se hincha porque
- así disminuye la presión en su interior y se equilibra con la externa.
- aumenta la presión dentro del globo.
- así contrarresta el aumento de la presión en el interior de la campana.
- se hace el vacío dentro del globo.
4. Si el volumen de un gas ideal aumenta el doble, y la temperatura permanece constante, la presión del gas ...
- se reduce a la mitad.
- se reduce a la cuarta parte.
- aumenta al doble.
- se mantiene constante.
5. Al extraer aire en la experiencia siguiente, el agua comienza a hervir aunque su temperatura es inferior de 100ºC…
- para sustituir el vapor de agua que hay en el interior de la campana.
- porque se alcanza la presión de vapor a la temperatura del agua.
- porque aumenta la temperatura del agua al extraer el aire.
- porque se forman corrientes de convección en el agua.
6. La presión de vapor es …
- la presión en la que coexisten en equilibrio agua, vapor y hielo.
- siempre es la presión atmosférica.
- la presión en la que un líquido se encuentra en equilibrio con su propio vapor.
- la presión a la que el agua se convierte en vapor.
7. ¿Por qué no se puede cocer un huevo en el Everest? (la temperatura de cocción del huevo es de 70ºC)
- Porque la presión es menor y se necesita una atmósfera de presión para cocerlo.
- Porque al ser la presión es menor el agua se evapora enseguida
- Porque al ser menor la presión la temperatura de ebullición aumenta
- Porque al ser menor la temperatura, el agua hierve antes de alcanzarse la temperatura de cocción.
Autores: Enric Valor y Juan Zúñiga