Montaje compacto de Arbor Scientific.
La ley de Boyle-Mariotte (o ley de Boyle) es una de las leyes de los gases ideales que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que el volumen es inversamente proporcional a la presión:
p V = cte
Esta ley es una simplificación, particularizada para procesos isotermos, de la ley de los gases ideales
p V = n RT
donde T es la temperatura termodinámica (en K), n es el número de moles de gas y R es la constante universal de los gases.
Con el montaje de la fotografía, se puede observar fácilmente que cuando disminuye el volumen aumenta la presión, mientras que si el volumen aumenta la presión disminuye. Manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
p1V1 = p2V2
Se sugiere elaborar una tabla con varios valores de presión y volumen y comprobar que el producto pV tiene una valor similar. A continuación se muestra un ejemplo para T =23.5ºC
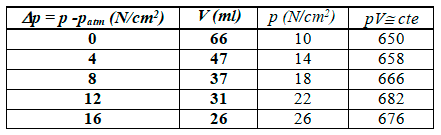
La forma de proceder sería la siguiente:
- Se abre la válvula roja para que entre aire en el cilindro (posición de la válvula en el sentido de la conducción)
- Se sube el émbolo del cilindro totalmente. Con la válvula abierta el manómetro debe marcar cero. Esto significa que la presión en el interior del cilindro es de 1 atm @ 10 N/cm2.
- Se cierra la válvula (posición perpendicular a la conducción)
- Se baja el émbolo despacio hasta la altura deseada. Debe esperarse unos segundos a que se estabilice la temperatura (el aire en el interior del cilindro llega al equilibrio térmico con el entorno, a temperatura ambiente).
- Se anotan en la tabla los valores de la presión (lectura del manómetro en N/cm2) y del volumen (posición del émbolo en la escala del cilindro, en ml).
Dado que el error de la presión es grande, se sugiere bajar el émbolo controlando la presión (por ejemplo cada dos divisiones enteras), y hacer la lectura del volumen, que permite muchos más valores intermedios.
Se propone conectar el termopar al multímetro y mostrar a los alumnos que si los dos extremos están a temperatura ambiente, este marca aproximadamente cero. Si se calienta una de las soldaduras y la otra se deja al aire, el multímetro empieza a marcar de forma ascendente.
Es interesante además que el alumno vea de cerca las dos soldaduras de los metales.
El termopar acaba en dos terminaciones que se conectan al multímetro. En concreto, una debe ir en la conexión COM y la otra en la conexión V/. Además, debe situarse el multímetro en la posición 200 mV correspondiente a corriente continua (DCV).
Si el multímetro es suficientemente preciso, basta calentar con la mano una de las dos soldaduras manteniendo la otra al aire. En caso contrario, se puede calentar la soldadura con el mechero que se adjunta en la demostración.
Cuidado con las cubiertas de vidrio y las conexiones.